2.3 Le transport des nutriments
Transporteurs de glucose
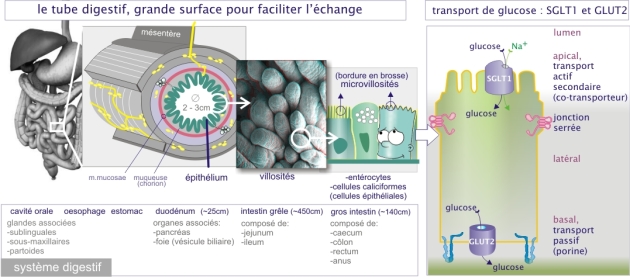
La cellule a deux façons de transporter le glucose :
Un transport actif-secondaire effectué par le symport Na+-glucose (SGLT-1, sodium glucose cotransporter-1). Ce transporteur (poids moléculaire de 60kDa et constitué de 12 hélices \(-\alpha\) transmembranaires) est abondant dans l'épithélium du tube digestif et du tubule rénal (néphron). Il utilise le fort gradient transmembranaire de Na+ (mis en place par l'ATPase Na2+/K+) pour faire pénétrer spécifiquement le glucose dans la cellule avec un rapport de un glucose pour un Na+.
Un transport passif effectué par les perméases du glucose (GLUT-1 à GLUT-5, glucose transporter). Les protéines réalisant cette opération ont un poids moléculaire d'environ 54kDa et sont formées de 12 hélices \(-\alpha\) dont certaines se juxtaposent en ménageant un pore central hydrophile. Bien qu'initialement caractérisées comme transporteurs de glucose, certaines protéines appartenant à la même famille se sont avérées pouvoir aussi transporter d'autres sucres. Par exemple, GLUT-2 transporte non seulement le glucose mais aussi le fructose et le galactose alors que GLUT-5 transporte spécifiquement le fructose.
Ces deux types de transporteurs du glucose sont associés dans la fonction physiologique du transport de glucose à travers l'épithélium du tube digestif : le glucose intestinal est activement transporté à l'intérieur des entérocytes (cellules de l'épithélium intestinal) par des transporteurs Na+-glucose (symport par SGLT-1) localisés dans la région apicale de la membrane. L'élévation de la concentration intracellulaire en glucose qui en résulte entraîne sa sortie au pôle basal de la cellule grâce à une perméase glucose (GLUT-2). La localisation sélective des deux types de transporteurs du glucose au sein des deux pôles membranaires de l'entérocyte est essentielle au transport orienté et constitue un excellent exemple de polarité structurale et fonctionnelle cellulaire.
![]()
Macromedia Flash - 49Ko
Transporteurs d'acides aminés
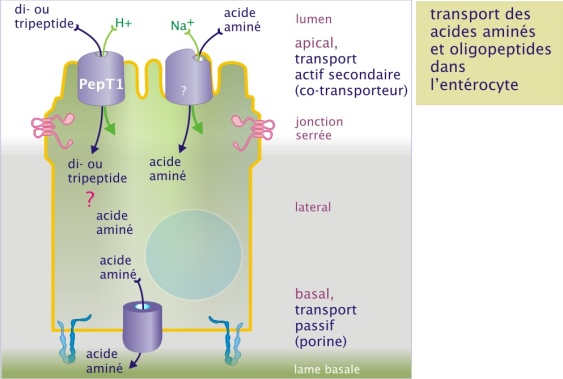
Même si nous internalisons des grammes d'acides aminés chaque jour, les protéines impliquées dans leur transport (dans le tube digestif) demeurent mal caractérisées. Le passage des acides aminés à travers la membrane plasmique de l'entérocyte est instrumentalisé par un symport fonctionnant à l'aide du gradient de sodium (Na+) ou de protons (H+). Dû à l'extrême acidité du ventre, le gradient de H+ est très fort dans la première partie de jéjunum (intestine grêle) et c'est le transporteur de di- ou tri-peptides, PepT1, qui en profite. Ce transporteur semble le plus important pour l'apport en matière d'acides aminés. Ce transport actif-secondaire est également impliqué dans le passage des antibiotiques de type beta-lactame (les pénicillines et céphalosporines). Les co-transporteurs Na+-dépendantes jouent également un rôle mais sont trop peu caractérisés (figure 10b).
![]() Pour en savoir plus sur les transporteurs de sucres et d'acides aminés :
Pour en savoir plus sur les transporteurs de sucres et d'acides aminés :
Transporteurs ABC
Ces transporteurs constituent une grande famille d'ATPases (500 membres à ce jour) à localisations ubiquitaires et transportent des acides aminés, sucres, polysaccharides, acides gras, peptides et ions. Les protéines réalisant cette opération ont un poids moléculaire d'environ 140kDa et sont formées de 12 hélices \(-\alpha\). Ces transporteurs sont caractérisés par une séquence précise d'acides aminés localisée dans le domaine cytoplasmique : il s'agit de l'ATP-binding cassette, impliquée dans la fixation de l'ATP (deux cassettes par transporteur). C'est l'hydrolyse de l'ATP qui produit ce transport mais le mécanisme exact de passage des solutés n'est pas encore bien compris. Notre connaissance actuelle de cette famille a bénéficié d'études sur la résistance des micro-organismes aux antibiotiques. C'est l'expression excessive de certains de ces transporteurs, bien conservés au cours d'évolution, qui est responsable de l'élimination par l'agent pathogène d'antibiotiques tels que la tétracycline par Staphylococcus aureus ou la chloroquine par Plasmodium falciparum (agent de la malaria). Les cellules cancéreuses sont capables d'en exprimer très fortement certains; la surexpression de la P-glycoprotéine-170 (P170) est responsable d'une multirésistance aux drogues (MDR) et donc à la chimiothérapie anti-cancéreuse.
![]() Pour en savoir plus sur les transporteurs associés à la multi résistance aux médicaments :
Pour en savoir plus sur les transporteurs associés à la multi résistance aux médicaments :
« Un article de revu [pdf] » (1310 Ko)