2.2 Maintien des concentrations ioniques
L'ATPase Na+/K+ ou pompe NA+/K+
La concentration en K+ est typiquement 30 à 40 fois plus élevée à l'intérieur des cellules qu'à l'extérieur, alors que la situation est inversée pour Na+ (). Ces différences sont engendrées et maintenues par une ATPase de la membrane plasmique qui se comporte comme une pompe expulsant activement 3 ions Na+ vers l'extérieur de la cellule et important deux ions K+ vers l'intérieur. L'ATPase Na+/K+ diminue ainsi la concentration intracellulaire d'ions positifs. Elle est donc électrogénique (et impliquée dans la mise en place d'un potentiel électrique membranaire). Le transport de Na+ et K+ est étroitement couplé à l'hydrolyse de l'ATP pour le transfert des deux ions contre leur gradient électrochimique (transport actif primaire).
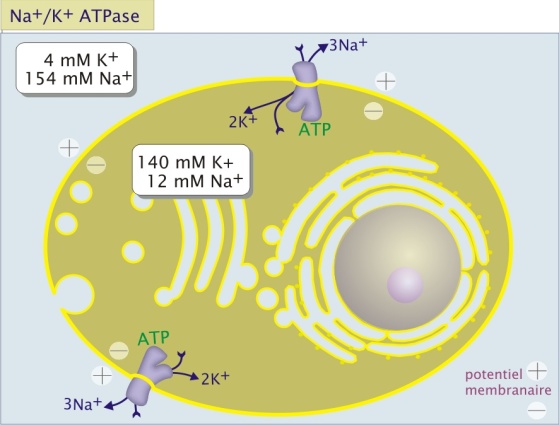
L'ATPase Na+/K+ (classe P), comme la plupart des autres pompes, est constituée de trois protéines étroitement liées (sous-unités \(\alpha,\beta,\lambda\), respectivement d'un poids moléculaire de 110 kDa, 40 kDa et 8 kDa). Son mécanisme moléculaire de transport exige trois étapes :
fixation des ions à haute affinité,
transfert des ions au travers de la membrane, et
réduction d'affinité qui permet la libération des ions.
Ce dynamisme est engendré par la fixation de l'ATP et son hydrolyse subséquente, qui se traduit par une phosphorylation transitoire du transporteur sur le résidu aspartate 369 (comme montré pour la Ca2+-ATPase dans l'animation de la figure 6). Il est vraisemblable que l'ensemble hydrolyse/phosphorylation/déphosphorylation soit nécessaire au transport des ions. Expérimentalement il est possible d'inhiber l'ATPase Na+/K+ par l'ouabaïne, glycoside extrait de la digitale.
Le gradient Na+/K+ généré de part et d'autre de la membrane est essentiel au fonctionnement de la cellule. Il est impliqué dans diverses fonctions :
régulation du pH,
régulation du volume cellulaire,
transport de nutriments tels que glucose et certains acides aminés,
transmission du signal dans le système nerveux (potentiel d'action).
La différence de potentiel transmembranaire
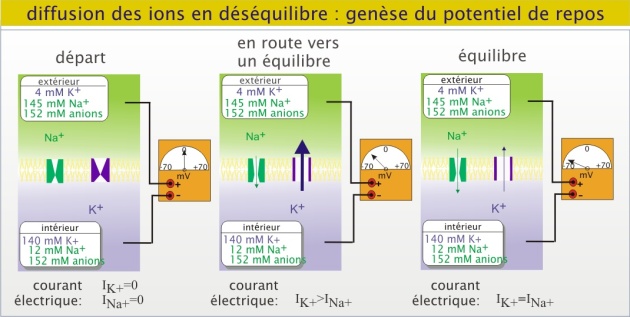
La différence de potentiel transmembranaire, ou potentiel de membrane, d'une cellule animale est proche de -70mV, la face cytoplasmique étant chargée négativement par rapport à la face externe. Le potentiel de membrane est le résultat de mouvements ioniques transmembranaires. Ces mouvements sont la conséquence d'une distribution inégale de part et d'autre de la membrane des ions et macromolécules chargées (comme les glucides complexes, les nucléotides et les protéines). Cette distribution est elle- même la conséquence de transports transmembranaires actifs avec une contribution majeure de l'ATPase Na+/K+.
Dans un état « repos » c'est le mouvement de K+ au travers de la membrane qui prédomine, parce qu'il y a plus de canaux potassiques que de canaux sodiques ouverts. En conséquence, la valeur du potentiel de repos est essentiellement déterminée par le mouvement de K+. Grâce à sa concentration intracellulaire très élevée, le K+ sort de la cellule en polarisant la face cytoplasmique négativement par rapport à la face externe. Le potentiel ainsi créé s'oppose au mouvement suivant de K+ au travers de la membrane, c'est-à-dire que le gradient électrochimique de K+ diminue. Sans la présence de Na+, le potentiel atteint la valeur de -90mV (potentiel d'équilibre du potassium), valeur pour laquelle il y a équilibre entre les deux forces (gradient électrochimique du potassium nul). Cependant, le potentiel de membrane créé par le K+, induit une augmentation considérable du gradient électrochimique du Na+ ce qui provoque un flux entrant de Na+ de plus en plus important. A un moment donné, <1ms, il s'installe un équilibre dynamique où il y autant de K+ qui sortent que de Na+ qui entrent (courant net nul) : c'est le potentiel de membrane de repos.
![]()
Macromedia Flash - 25Ko
Comme on le verra plus-tard, l'ouverture d'un plus grand nombre de canaux qui laissent passer le Na+ (le récepteur à l'acétylcholine et le canal de Na+ dépendant du voltage) va faire basculer les événements ; c'est la mobilité de Na+ qui prédomine et détermine principalement la valeur du potentiel transmembranaire (par exemple lors du potentiel d'action).
Il est important de savoir que les flux ioniques responsables du potentiel de repos n'impliquent que des quantités minimes (de l'ordre de la picomole) par rapport aux concentrations ioniques de la cellule et son environnement (de l'ordre de la millimole). A court terme, ces mouvements n'ont pas d'effets importants sur la concentration des ions, intra ou extracellulaire. En revanche, lorsqu'on inhibe l'ATPase Na+/K+ par de l'ouabaïne, la cellule perd progressivement (plusieurs minutes) son potentiel de membrane et son volume augmente à la suite d'un gain net en ions intracellulaires. Une part considérable (25 à 50%) de l'ATP cellulaire disponible sert à maintenir les gradients de concentration d'ions à travers la membrane plasmique et les membranes intracellulaires.
L'ATPase Ca2 +ou pompe à Ca2 +
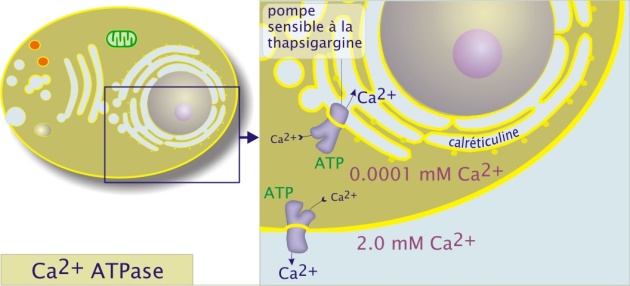
Les cellules animales maintiennent des concentrations intracellulaires très faibles de Ca2+ (). Comme on le verra plus tard, les ions Ca2+ sont étroitement impliqués dans les voies de signalisation commandant la contraction musculaire, l'exocytose et l'activation de divers types cellulaires en réponse à un stimulus extérieur (exemple des lymphocytes T). Les ATPases Ca2+ (classe P) sont des protéines de poids moléculaire d'environ 110kDa. Elles sont situées dans la membrane plasmique mais aussi dans la membrane du réticulum endoplasmique (réticulum sarcoplasmique pour les cellules musculaires ou l'ATPase Ca2+ représente 90% des protéines membranaires). Les ATPases Ca2+ sont différentes selon leur localisation comme le montre l'utilisation d'inhibiteurs spécifiques. Par exemple, l'ATPase Ca2+ du réticulum endoplasmique, spécifiquement inhibée par la thapsigargine, est, par ailleurs, régulée par une petite protéine membranaire (6kDa) qui s'assemble en homopentamère, le phospholamban.
A l'intérieur du réticulum endoplasmique la concentration en Ca2 + libre est tamponnée par la calciréticuline, une protéine qui fixe 20 ions Ca2 + par molécule.
D'un point de vue structure/fonction, cette ATPase ressemble beaucoup à l'ATPase Na+/K+ mais elle est sélective du Ca2+. Son activité - déclenchée par l'hydrolyse d'ATP, suivie par une phosphorylation/déphosphorylation de l'acide aspartique 351- se traduit par le passage simultané de deux ions Ca2+.