TP 3 – Pharmacophore du récepteur de l'adrénaline
Partie
Objectif : Créer un pharmacophore des molécules agissant sur les récepteurs adrénergiques. Proposer un ligand potentiel sur la base du pharmacophore établi.
Avant-propos :
Un pharmacophore représente les positions relatives en trois dimensions de groupements fonctionnels commun à un ensemble de molécules possédant toutes la même action pharmacologique. On présuppose que ces propriétés structurales communes sont importantes dans les interactions qu'elles sont susceptibles de former avec la cible pharmacologique. Pour plus de détails sur les caractéristiques de ces sites pharmacophoriques se référer au cours correspondant.
Le logiciel utilisé dans ce TP, Avogadro, n'est pas un logiciel dédié à l'identification de pharmacophore mais va nous servir à mesurer des propriétés structurales communes à différentes molécules.
Question
Partie 1/ Analyse 2D du pharmacophore
Question 1 :
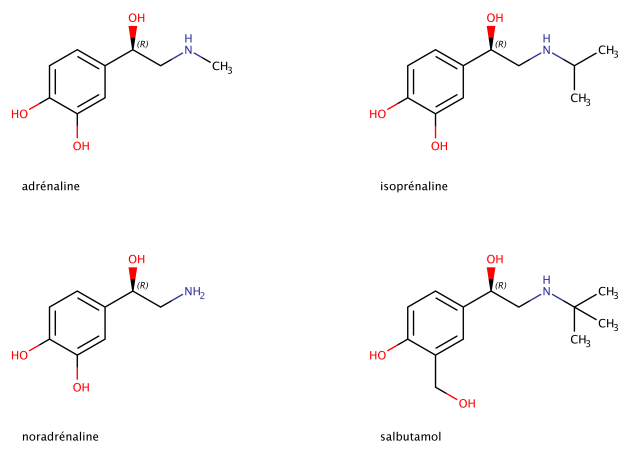
Écrire les structures en 2D des molécules suivantes : adrénaline, noradrénaline, isoprénaline et le salbutamol. A quelle famille chimique appartiennent ces molécules ?
Solution détaillée
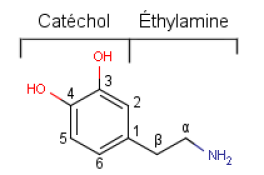
Ces quatre molécules font partie de la famille chimique des catécholamines. Elles possèdent un noyau aromatique de type diphénol et une chaîne aliphatique de type éthylamine (cf. Figure 2)
Question
Question 2 :
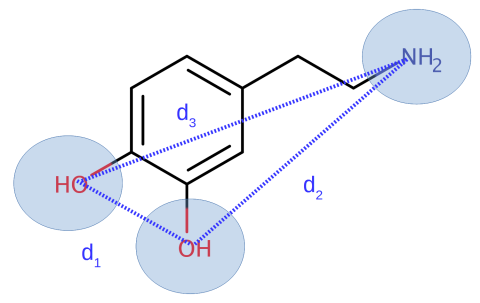
Retrouver le squelette commun à toutes ces molécules. Identifier les trois sites pharmacophoriques principaux et noter les caractéristiques structurales de ce pharmacophore.
Solution détaillée
Puisque ces molécules font partie de la famille des catécholamines, le squelette commun comporte un cycle aromatique, deux fonctions hydroxyles, et une fonction amine. Pour représenter un pharmacophore 2D, nous avons choisi de sélectionner les deux fonctions hydroxyle et le groupement amine qui sont des sites pharmacophoriques de type accepteur/donneur de liaison hydrogène (Cf. Figure 3). Les distances d1, d2 et d3 seront pour la suite les propriétés structurales caractéristiques du pharmacophore.
Remarque :
Il est possible de complexifier le pharmacophore en intégrant le cycle aromatique. Cependant pour la suite du TP, nous illustrerons le concept de pharmacophore avec uniquement ces trois groupements fonctionnels par souci de simplicité.
Question
Partie 2/ Analyse structurale des ligands
Pour chacune des molécules précédentes, construire sa structure avec Avogadro et lancer un calcul d'optimisation de géométrie (Cf. TP1 pour la principe de minimisation d'énergie).
Question 3 :
Construire le pharmacophore 3D associé à ces quatre molécules. Pour cela relever les distances caractéristiques reliant les sites pharmacophoriques.
Solution détaillée
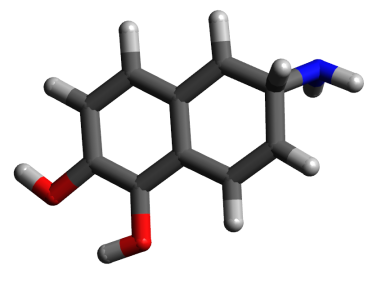
La figure 4 représente la structure optimisée de l'adrénaline et les distances d1 d2 d3 définies dans la question précédente. Le tableau 1 résume les caractéristiques structurales du pharmacophore pour les quatre molécules.
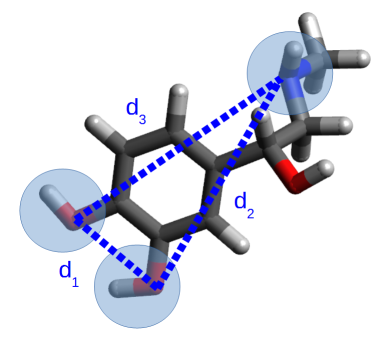
Molécules | d1 | d2 | d3 |
adrénaline | 2,709 | 6,540 | 6,729 |
noradrénaline | 2,710 | 6,857 | 7,838 |
isoprénaline | 2,708 | 7,045 | 7,832 |
salbutamol | 2,548 | 7,728 | 6,687 |
Pharmacophore (distance moyenne et écart type) | 2,7 ± 0,1 | 7,0 ± 0,4 | 7,3 ± 0,6 |
Remarque :
Il est inutile de retenir trois chiffres significatifs sur un calcul de distance avec une approche mécanique moléculaire. C'est pourquoi nous n'avons retenu qu'un seul chiffre significatif pour les distances moyennes dans le pharmacophore. Par ailleurs, les distances ont été mesurée sur une structure unique. Il serait préférable de réaliser ces mesures sur un ensemble de structures représentatives des différents états d'énergie minimale de chacune des molécules. Pour cela un échantillonnage des différents états conformationnels des molécules devrait être réalisé. Une pondération selon la statistique de Boltzmann devrait alors être appliquée aux caractéristiques structurales pour avoir une représentation plus réaliste du pharmacophore.
Question
Partie 3/ Design d'un nouveau ligand
L'objectif est ici de proposer une structure susceptible de répondre aux critères du pharmacophore précédemment établi.
Question 4 :
Construire une nouvelle molécule, lancer un calcul d'optimisation de géométrie et vérifier si cette molécule est conforme au modèle.
Solution détaillée
Nous avons choisi de contraindre la flexibilité de la chaîne éthylamine. La molécule représentée sur la figure 5 semble conforme au pharmacophore. La molécule respecte 2 critères sur 3 et, même si la distance d2 est légèrement plus faible que dans le modèle, les distances entre les sites pharmacophoriques sont proches de la gamme des valeurs autorisées :
d1 = 2,682 Å
d2 = 6,126 Å
d3 = 7,417 Å
La molécule peut donc être considéré comme un ligand potentiel vis-à-vis de la cible thérapeutique commune aux quatre molécules choisies pour établir le pharmacophore, ici les récepteurs adrénergiques. En revanche il est impossible de savoir si cette molécule est un angoniste, un antagoniste ou un inhibiteur.
Dans un objectif de recherche en Drug Design, il serait plus pertinent d'utiliser une plus grande base de données de molécules. Par ailleurs, les molécules choisies dans ce TP sont très proches d'un point de vue structural ce qui rend peu tolérant le modèle pharmacophore vis-à-vis de molécules originales.