5.3.1 Généralités
Tout le monde sait, pour l'avoir appris, qu'un magnésien est une espèce très réactive, et qu'il doit être généré et utilisé dans un milieu ne contenant pas d'eau, c'est-à-dire dans un solvant anhydre. En effet, l'eau aurait comme action de détruire le magnésien, par réaction acido-basique.
Donc, comme solvant anhydre, on utilise de l'éther fraîchement distillé (éther + sodium + benzophénone = solution bleue, signe que l'éther qui se distille est anhydre).
La question que l'on se pose est : « Pourquoi utiliser l'éther et non pas un autre solvant ? »
Deux réponses à cela :
D'abord, le solvant à utiliser ne doit pas contenir de protons acides qui seraient susceptibles de réagir avec le magnésien et donc de le détruire.
Ensuite, l'éther coordine le magnésien le rendant ainsi plus stable. En effet, la liaison carbone magnésium est à la fois ionique et covalente, il en résulte un équilibre dit "Équilibre de Schlenk".
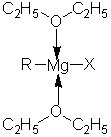 Fig. 8 | Donc si l'éther coordine le magnésien, celui-ci ne suit plus l'équilibre de Schlenk. On conserve donc dans le milieu le magnésien sous la forme RMgX. |
Application :
ArMgX est la forme prédominante dans l'éther, par contre on la trouve en très faible proportion quand le THF est le solvant.
Conclusion :
On remarque que c'est le choix du solvant qui détermine la position de l'équilibre de Schlenk. Notons que certains magnésiens peuvent être préparés dans la triéthylamine.





