Titrage de l'acide ascorbique (Bac S Antilles 2014)
Titrage de l'acide ascorbique par suivi pH-métrique.
On souhaite vérifier l'indication figurant sur une boîte de comprimés de vitamine C vendue en pharmacie : le fabricant annonce que la masse d'acide ascorbique est de 500 mg par comprimé.
Un comprimé de vitamine C est écrasé dans un mortier. La poudre est ensuite dissoute dans une fiole jaugée de 200,0 mL que l'on complète avec de l'eau distillée jusqu'au trait de jauge en homogénéisant le mélange. On obtient la solution S.
On prélève 10,0 mL de cette solution que l'on titre avec une solution d'hydroxyde de sodium
(
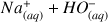 ) de concentration molaire
) de concentration molaire
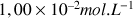 .
.
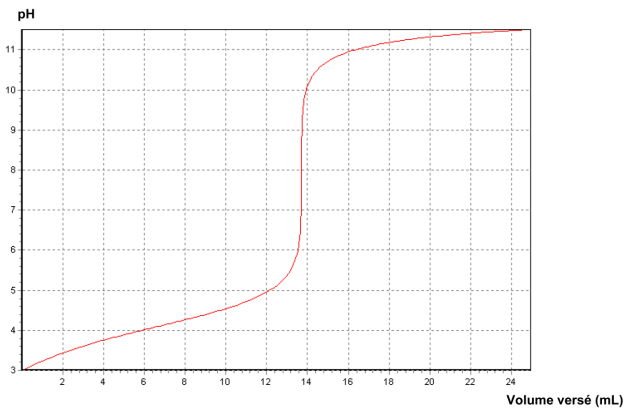
On suit le titrage par pH-métrie. Le graphique représentant l'évolution du pH en fonction du volume de solution d'hydroxyde de sodium versé est représenté ci-dessous.
L'acide ascorbique sera noté AH dans la suite de l'exercice et sa masse molaire est
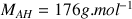
Question
L'ion hydroxyde est une base forte en solution aqueuse.
Déterminer le pH de la solution d'hydroxyde de sodium utilisée pour le titrage.
D'après l'énoncé la concentration en ions
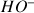 dans la solution de soude titrante est
dans la solution de soude titrante est
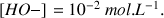
On détermine
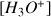 à partir du produit ionique de l'eau
à partir du produit ionique de l'eau
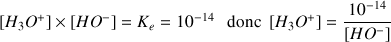
A.N.
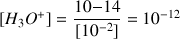
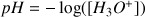
A.N.
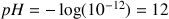 . C'est une solution très basique
. C'est une solution très basique
Question
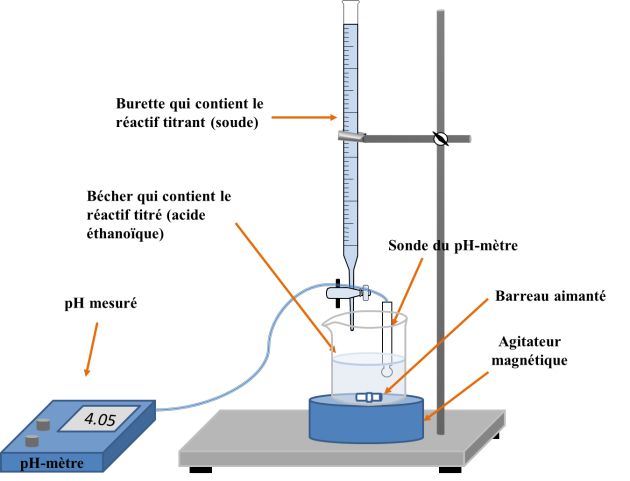
Réaliser un schéma annoté du montage expérimental nécessaire à la mise en œuvre du titrage.
Question
Écrire l'équation de la réaction support du titrage.
L'équation de la réaction support de titrage est :
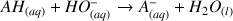
Question
À partir du protocole mis en œuvre et des résultats obtenus, déterminer la masse d'acide ascorbique contenue dans le comprimé.
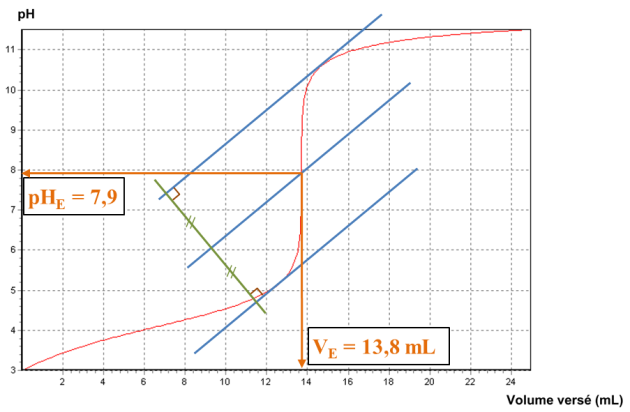
A partir de la méthode des tangentes on détermine le point d'équivalence de coordonnées
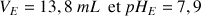
D'après la réaction de titrage on déduit la concentration en acide ascorbique de la solution dans le bécher.
Avec la réaction de titrage 1 :
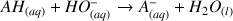
D'après le cours on a
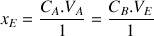 donc
donc
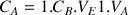
avec :
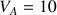 mL
mL
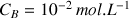
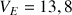 mL (voir courbe de dosage)
mL (voir courbe de dosage)
A.N.
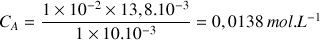
La concentration massique
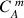 est
est
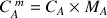
avec
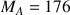 g/mol masse molaire de l'acide ascorbique
g/mol masse molaire de l'acide ascorbique
A.N.
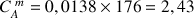 g/L
g/L
La concentration massique dans la fiole initiale de volume
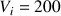 mL (dans laquelle on a dissous le comprimé d'acide ascorbique) est donc la même, à savoir 2,41 g/L
mL (dans laquelle on a dissous le comprimé d'acide ascorbique) est donc la même, à savoir 2,41 g/L
La masse contenue dans les 200 mL est
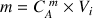
A.N.
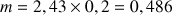 g
g
Question
Préciser les sources d'erreurs possibles. Calculer l'écart relatif entre la masse théorique et la masse expérimentale. Commenter la valeur obtenue.
Sources d'erreurs possibles :
Au cours de la fabrication du comprimé il peut exister un écart entre la quantité prévue de vitamine C et celle qui est réellement mise dans le comprimé
Il y a des risques de perte de poudre au cours du broyage du comprimé et du transvasement de la poudre obtenue.
Il existe des erreurs inhérentes à toute procédure de dosage : prélèvement des volumes, préparation de la fiole jaugée, stabilisation du pH, ...
La valeur déterminée par titrage est proche de la valeur annoncée par le flacon (500 mg d'acide ascorbique dans le comprimé).
L'écart relatif est :
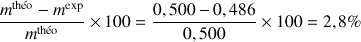
L'écart relatif entre la masse théorique et la masse obtenue à partir du titrage est faible.
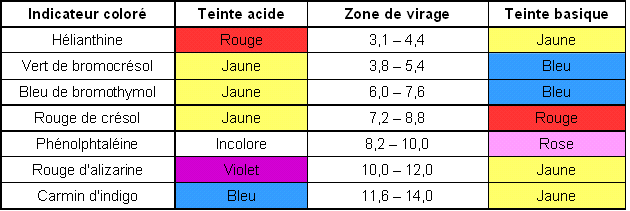
Utilisation d'un indicateur coloré
Parmi les indicateurs colorés proposés, lequel utiliseriez-vous pour le titrage de l'acide ascorbique par la solution d'hydroxyde de sodium effectué dans la partie 1 ?
Question
Justifier la réponse et préciser comment l'équivalence est repérée.
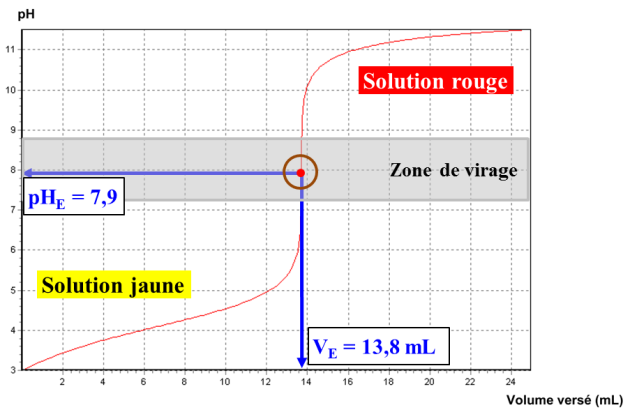
D'après la courbe de titrage
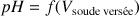 , le pH observé à l'équivalence est
, le pH observé à l'équivalence est
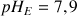 .
.
Dans le tableau des indicateurs colorés donné ci-dessus on va rechercher ceux qui ont une zone de virage qui contient cette valeur de
 .
.
Il y a un indicateur coloré qui peut être utilisé pour caractériser l'équivalence de ce titrage :
Le rouge de Crésol avec sa zone de virage 7,2 – 8,8
Au passage de l'équivalence la solution passera de la couleur jaune (milieu acide avec pH < 7,2) à la couleur rouge (milieu basique avec pH > 8,8 ). Dans la zone de virage la couleur de la solution sera un mélange des couleurs jaune et rouge. On notera le volume de soude versé au moment où on observe le mélange de couleur, il s'agit de
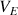 . Quand on ajoute une goutte de plus, la couleur de la solution doit être parfaitement rouge. Au cours de cette mesure on observe un saut de pH brusque, on observera donc facilement le changement de couleur à l'équivalence.
. Quand on ajoute une goutte de plus, la couleur de la solution doit être parfaitement rouge. Au cours de cette mesure on observe un saut de pH brusque, on observera donc facilement le changement de couleur à l'équivalence.