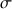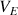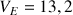Teneur en ions d'une bouteille d'eau minérale
Afin de vérifier la teneur en ions sulfate
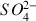 d'une bouteille d'eau minérale on va procéder à un titrage direct par conductimétrie. Pour cela on prélève un volume de 100 mL d'eau dans la bouteille que l'on verse dans un bécher. On fait le dosage en mettant dans la burette une solution de chlorure de Baryum
d'une bouteille d'eau minérale on va procéder à un titrage direct par conductimétrie. Pour cela on prélève un volume de 100 mL d'eau dans la bouteille que l'on verse dans un bécher. On fait le dosage en mettant dans la burette une solution de chlorure de Baryum
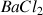 (
(
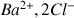 ) de concentration
) de concentration
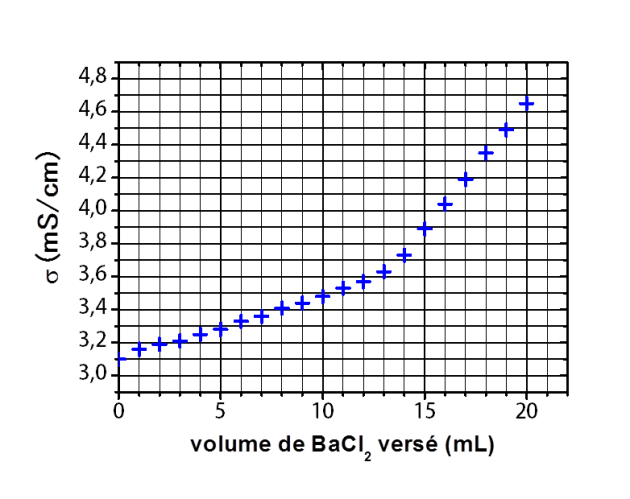
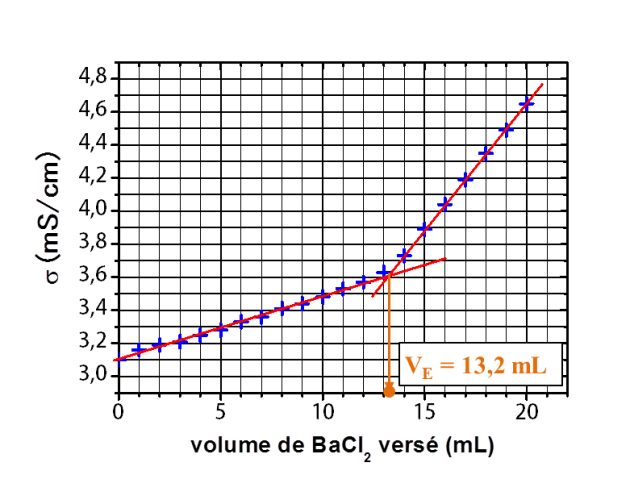
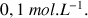 L'évolution de la conductimétrie au cours du dosage est donnée dans la figure ci-dessous et la réaction mise en jeu est :
L'évolution de la conductimétrie au cours du dosage est donnée dans la figure ci-dessous et la réaction mise en jeu est :
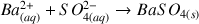
Données :
conductivités molaires ioniques en
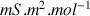 :
:
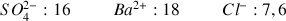
Masses molaires ioniques en
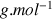 :
:
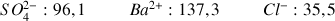
Question
Quel est le réactif titré ? Quel est le réactif titrant ?
espèce titrée : ions sulfate espèce titrante : ion baryum
Question
Donner la définition de l'équivalence lors d'un dosage.
L'équivalence d'un titrage est atteinte lorsqu'on a réalisé un mélange stœchiométrique du réactif titrant et titré. Tous les réactifs sont consommés
Question
Donner la valeur du volume équivalent.
Question
Déduire de l'équivalence la concentration en
 des ions sulfate dans l'eau minérale.
des ions sulfate dans l'eau minérale.
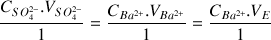 donc
donc
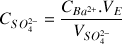
A.N.
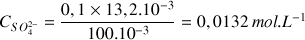
Question
Calculer cette concentration en
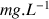 et la comparer à la valeur indiquée sur la bouteille : 1350 mg/L.
et la comparer à la valeur indiquée sur la bouteille : 1350 mg/L.
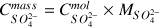
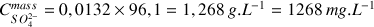
Valeur relativement proche de la valeur attendue avec un écart relatif de
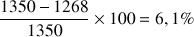
Question
Quels sont les ions présents avant l'équivalence en ne considérant que les ions évoqués dans l'énoncé ? Même question après l'équivalence.
avant l'équivalence :
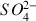 ,
,
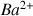 et
et
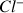
après l'équivalence :
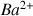 et
et
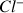
Question
En ne considérant que les ions évoqués dans l'énoncé quelle évolution de la conductivité aurait dû être observée avant l'équivalence (forte/faible augmentation/diminution de la conductivité ?)
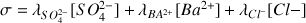
Avant l'équivalence
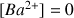 (les ions
(les ions
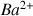 sont consommés)
sont consommés)
2 ions
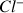 remplacent un ion
remplacent un ion
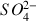 . Or
. Or
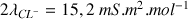 et
et
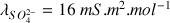 donc on aurait attendu une légère diminution de la conductivité.
donc on aurait attendu une légère diminution de la conductivité.