Détermination de la concentration initiale d'une solution de peroxyde d'hydrogène (Bac S réunion 2007)
L'eau oxygénée commerciale est une solution aqueuse de peroxyde d'hydrogène (
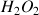 ) utilisée comme désinfectant pour des plaies, pour l'entretien des lentilles de contact ou comme agent de blanchiment.
) utilisée comme désinfectant pour des plaies, pour l'entretien des lentilles de contact ou comme agent de blanchiment.
La concentration en peroxyde d'hydrogène,
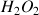 , est indiqué par le titre en eau oxygénée qui s'exprime en unité de volumes. Par définition, le titre est le volume de dioxygène (exprimé en litres) libéré par un litre de solution aqueuse de peroxyde d'hydrogène suivant la réaction de dismutation (dans les conditions normales de température et de pression) suivante :
, est indiqué par le titre en eau oxygénée qui s'exprime en unité de volumes. Par définition, le titre est le volume de dioxygène (exprimé en litres) libéré par un litre de solution aqueuse de peroxyde d'hydrogène suivant la réaction de dismutation (dans les conditions normales de température et de pression) suivante :
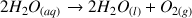
L'eau oxygénée du commerce se présente en flacons opaques afin d'éviter que la lumière favorise la transformation chimique précédente.
On désire vérifier la concentration en eau oxygénée d'un flacon qui porte la mention suivante : eau oxygénée à 10 volumes.
Données :
Volume molaire des gaz dans les conditions de l'expérience
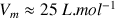
Question
Calcul de la valeur attendue de la concentration en peroxyde d'hydrogène.
Par définition du titre de l'eau oxygénée, quel volume de dioxygène V(O2) serait libéré par un volume V = 1,00 L de la solution commerciale au cours de la réaction de dismutation du peroxyde d'hydrogène ?
Dans l'énoncé il est indiqué :
le flacon contient une eau oxygénée à 10 volumes
un volume correspond au dégagement de 1 L de dioxygène pour 1 L de solution
Un litre de la solution va donc dégager 10 L de dioxygène
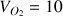 L
L
Question
Calculer la quantité de dioxygène formé au cours de cette transformation.
Par définition,
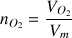 A.N. :
A.N. :
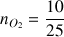
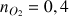 mol
mol
Question
La transformation précédente étant considérée comme totale, vérifier que la concentration en peroxyde d'hydrogène notée
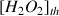 de cette solution commerciale (valeur théoriquement attendue) a pour valeur :
de cette solution commerciale (valeur théoriquement attendue) a pour valeur :
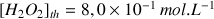
Tableau d'avancement
D'après le tableau d'avancement :
La réaction étant totale le réactif
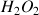 est entièrement consommé avec
est entièrement consommé avec
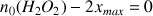
La quantité de dioxygène formé
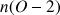 vérifie
vérifie
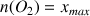 avec
avec
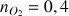 mol
mol
Donc :
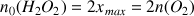 d'où
d'où
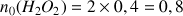 mol
mol
[
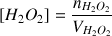
A.N.
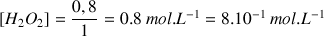
On retrouve bien le résultat attendu.
Détermination de la valeur réelle de la concentration en peroxyde d'hydrogène.
Pour vérifier la valeur de la concentration précédente, on réalise le titrage d'un volume
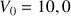 mL de cette solution par une solution de permanganate de potassium acidifiée de concentration en soluté
mL de cette solution par une solution de permanganate de potassium acidifiée de concentration en soluté
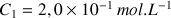 . Les couples oxydant-réducteur intervenant au cours du titrage sont
. Les couples oxydant-réducteur intervenant au cours du titrage sont
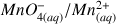 et
et
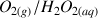 . Le volume de permanganate de potassium versé pour obtenir l'équivalence est
. Le volume de permanganate de potassium versé pour obtenir l'équivalence est
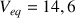 mL.
mL.
L'équation de la réaction de titrage est la suivante :
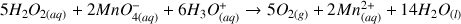
Question
L'ion permanganate
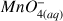 donne une coloration violette aux solutions aqueuses qui le contiennent.
donne une coloration violette aux solutions aqueuses qui le contiennent.
Comment l'équivalence est-elle repérée au cours du titrage ?
Avant l'équivalence les ions
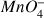 sont consommés car le permanganate est le réactif titrant (il est le réactif limitant). Après l'équivalence il n'y a plus de réactif titrant donc il ne peuvent plus être consommés. Ils apportent à la solution une coloration violette. C'est donc l'apparition de la coloration violette qui indique l'équivalence.
sont consommés car le permanganate est le réactif titrant (il est le réactif limitant). Après l'équivalence il n'y a plus de réactif titrant donc il ne peuvent plus être consommés. Ils apportent à la solution une coloration violette. C'est donc l'apparition de la coloration violette qui indique l'équivalence.
Question
Quelle relation peut-on écrire entre la quantité initiale de peroxyde d'hydrogène se trouvant dans le bécher
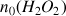 et la quantité d'ions permanganate introduits dans le bécher à l'équivalence
et la quantité d'ions permanganate introduits dans le bécher à l'équivalence
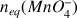 ?
?
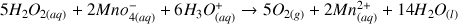
L'équivalence correspond à un mélange stœchiométrique des réactifs titrant (
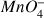 ) et titré (
) et titré (
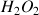 ) avec :
) avec :
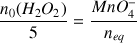 donc
donc
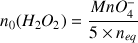
Question
Donner l'expression de la concentration en peroxyde d'hydrogène de la solution commerciale
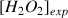 en fonction de
en fonction de
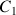 ,
,
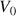 et
et
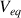 . Montrer que l'on a :
. Montrer que l'on a :
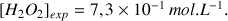
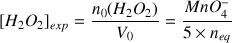 et
et
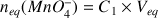
Donc
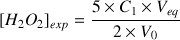
A.N.
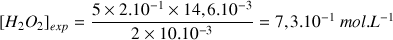
Question
Comparer à la valeur obtenue à la question 1.3. Les erreurs de manipulation mises à part, comment peut-on expliquer l'écart de concentration obtenu ?
On trouve une concentration plus faible que celle annoncée sur le flacon (titre de 10 volumes qui correspond à
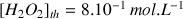 .
.
Il est indiqué dans l'énoncé que la lumière favorise la décomposition de
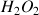 en
en
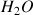 et
et
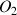 . On peut penser que cette réaction a pu démarrer dans le bécher qui n'est pas à l'abri de la lumière et cela a entraîné une diminution de la quantité de
. On peut penser que cette réaction a pu démarrer dans le bécher qui n'est pas à l'abri de la lumière et cela a entraîné une diminution de la quantité de
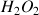 .
.






