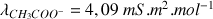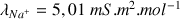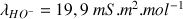Complément exemple 2
Exemple :
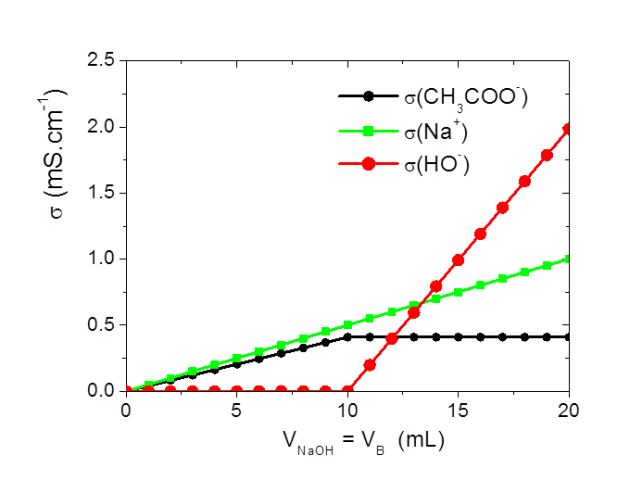
Évolution de sigma
On peut constater que contrairement à l'exemple 1 la conductivité augmente toujours au cours du titrage (avec l'existence de deux régimes linéaires distincts qui permettent de déterminer
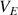 graphiquement)
graphiquement)
Bilan des ions dans la solution :
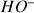 et
et
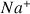 qui proviennent de la soude et
qui proviennent de la soude et
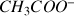 éthanoate base associée de l'acide éthanoïque (l'acide éthanoïque
éthanoate base associée de l'acide éthanoïque (l'acide éthanoïque
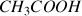 ne contribue pas à la conductivité de la solution car il ne porte pas de charge)
ne contribue pas à la conductivité de la solution car il ne porte pas de charge)
L'acide éthanoïque est un acide faible, on négligera pour décrire l'évolution de la conductivité au cours du titrage la dissociation initiale de l'acide.
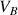 (volume de soude versé) <
(volume de soude versé) <
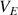 (volume versé à l'équivalence)
(volume versé à l'équivalence)Tous les ions
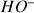 réagissent avec des molécules
réagissent avec des molécules
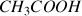 donc
donc
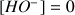 et
et
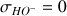
Les ions
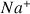 versés ne réagissent pas donc
versés ne réagissent pas donc
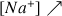 et
et
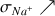
Toutes les molécules de
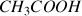 qui ont réagi avec les ions
qui ont réagi avec les ions
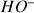 se sont transformées en ions
se sont transformées en ions
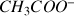 donc
donc
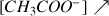 et
et
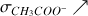
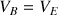
Tous les ions
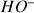 versés ont réagi avec toutes les molécules
versés ont réagi avec toutes les molécules
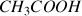 dans le bécher donc
dans le bécher donc
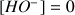 et
et
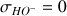
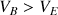
Il n'y a plus d'ions
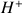 dans le bécher pour réagir avec les ions
dans le bécher pour réagir avec les ions
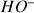 versés après l'équivalence donc
versés après l'équivalence donc
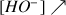 et
et
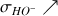
Les ions
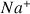 versés ne réagissent pas donc
versés ne réagissent pas donc
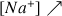 et
et
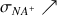
Il n'y a plus de molécules de
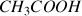 dans le bécher donc la réaction acido-basique ne peut plus se faire
dans le bécher donc la réaction acido-basique ne peut plus se fairedonc
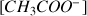 = constante et
= constante et
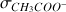 = constante
= constante
On peut observer l'évolution des différentes contributions à la conductivité totale sur la figure ci-dessous
avec :