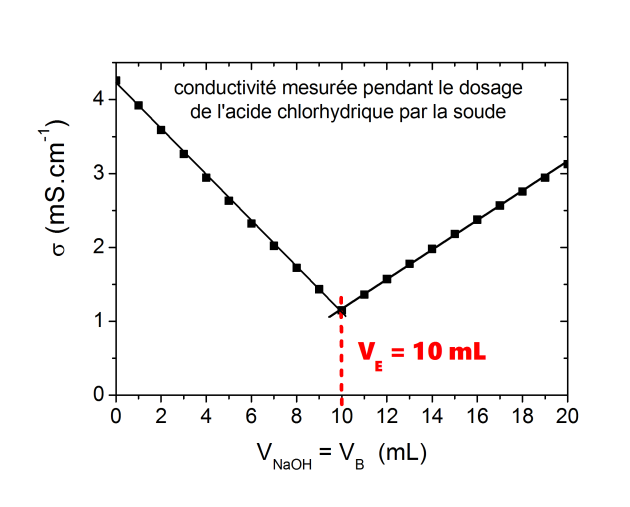Exemple 1
Exemple : Dosage d'une solution d'acide chlorhydrique par une solution de soude
On veut titrer une solution d'acide chlorhydrique (
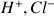 ) en utilisant comme réactif titrant de la soude (
) en utilisant comme réactif titrant de la soude (
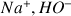 ) à partir de la réaction acido-basique suivante :
) à partir de la réaction acido-basique suivante :
Réaction :
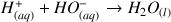
Dans le bécher on va placer un volume
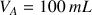 de la solution d'acide chlorhydrique de concentration
de la solution d'acide chlorhydrique de concentration
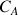 à déterminer (réactif titré) et dans la burette la solution de soude de concentration
à déterminer (réactif titré) et dans la burette la solution de soude de concentration
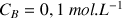 (réactif titrant). On verse progressivement un volume
(réactif titrant). On verse progressivement un volume
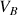 de soude dans le bécher (mL par mL) et on mesure la conductivité. A partir des points expérimentaux reportés sur un graphe
de soude dans le bécher (mL par mL) et on mesure la conductivité. A partir des points expérimentaux reportés sur un graphe
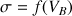 on trace deux segments de droite qui se croisent au point d'intersection qui a pour abscisse le volume d'équivalence
on trace deux segments de droite qui se croisent au point d'intersection qui a pour abscisse le volume d'équivalence
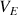 .
.
Ici le volume d'équivalence est
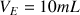 .
.
À partir de la relation suivante on va déterminer la concentration de la solution d'acide chlorhydrique :
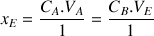 d'où
d'où
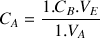
Pour les coefficients stœchiométriques on a : a = 1 et b = 1
Réaction :
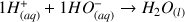
Avec
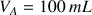
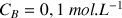
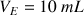
A.N.
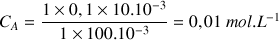
On retrouve l'expression
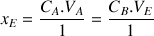 à partir du tableau d'avancement
à partir du tableau d'avancement
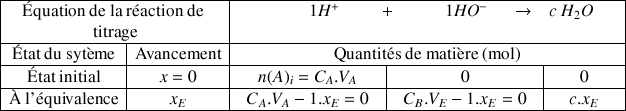
A l'équivalence les réactifs sont totalement consommés avec
Pour le réactif titré
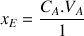
Pour le réactif titrant
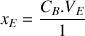
Remarque :
Si on trace l'évolution de la conductance G (grandeur mesurée par le conductimètre), au lieu de la conductivité
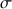 , en fonction du volume de réactif titrant versé, le volume de réactif titrant versé à l'équivalence,
, en fonction du volume de réactif titrant versé, le volume de réactif titrant versé à l'équivalence,
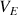 , sera toujours le même. On peut donc utiliser la grandeur G pour déterminer le point d'équivalence.
, sera toujours le même. On peut donc utiliser la grandeur G pour déterminer le point d'équivalence.