Introduction
Fondamental :
Le dosage par titrage direct est basé sur une réaction chimique, celle-ci doit être totale et rapide. On va déterminer la concentration de la solution étudiée à partir de l'équivalence du dosage.
Définition : Dosage, titre et titrage
Un dosage permet de déterminer la quantité d'une espèce chimique dans un échantillon. L'échantillon peut être sous forme solide, liquide ou gazeuse. Le titrage est un cas particulier de dosage qui est limité à la détermination de la concentration d'espèces chimiques en solution.
Le titre d'une solution est la concentration molaire ou massique (titre massique) d'un soluté.
Un titrage est une méthode expérimentale qui permet de déterminer la concentration (donc le titre) d'une espèce chimique en solution. Cette méthode est basée sur une réaction chimique qui fait intervenir l'espèce chimique dont on veut connaître la concentration (réactif titré, voir ci-dessous) et un réactif ajouté dans la solution (réactif titrant).
Définition : Réactif titrant, réactif titré
Au cours de la réaction utilisée pour le dosage, le réactif dont on cherche à connaître la concentration (exemple : solution d'acide chlorhydrique de concentration inconnue) appelé réactif titré réagit avec un réactif de concentration connue, appelé réactif titrant (exemple : solution d'hydroxyde de sodium de concentration
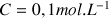 ).
).
Définition : Équivalence
L'équivalence d'un dosage correspond à un mélange stœchiométrique du réactif titrant et du réactif titré.
Autres façons de définir l'équivalence :
Tout le réactif titré et le réactif titrant versé ont été consommés à l'équivalence, ils sont tous les deux limitants (on rappelle que la réaction doit être totale pour faire un dosage).
Le nombre de moles de réactif titrant et réactif titré est nul à l'équivalence.
Définition : Volume d'équivalence
Le volume d'équivalence noté
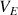 correspond au volume V de réactif titrant versé à l'équivalence
correspond au volume V de réactif titrant versé à l'équivalence
Pour
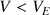 , le réactif titrant est limitant
, le réactif titrant est limitant
Pour
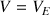 , le réactif titrant et titré sont limitants
, le réactif titrant et titré sont limitants
Pour
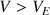 , le réactif titré est limitant
, le réactif titré est limitant
Méthode : Dispositif expérimental
Lorsqu'on réalise un dosage, on dispose :
d'un bécher dans lequel on place un volume connu de la solution à titrer dont la concentration est inconnue
d'une burette graduée dans laquelle on place la solution titrante de concentration connue. Le volume versé sera mesuré grâce à la burette.
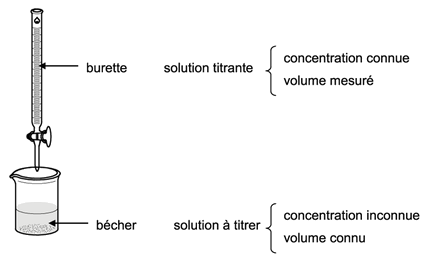
On ajoute progressivement le réactif titrant dans le bécher (avec agitation de la solution) et, pour chaque nouveau volume versé, on mesure la grandeur physique sélectionnée (conductivité
 , pH) ou on contrôle un changement de couleur de la solution (indicateur coloré).
, pH) ou on contrôle un changement de couleur de la solution (indicateur coloré).
Méthode : Tableau d'avancement
Considérons l'équation générale d'une réaction de dosage :
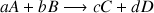
avec le A le réactif titré dont la concentration
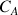 est à déterminer
est à déterminer
et B le réactif titrant dont la concentration
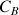 est connue. Le volume versé de B dans le bécher qui contient A (voir schéma ci-dessus) est
est connue. Le volume versé de B dans le bécher qui contient A (voir schéma ci-dessus) est
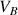 .
.
A l'équivalence l'avancement de la réaction est
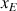 et le volume versé de B est
et le volume versé de B est
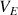 .
.
Les différentes quantités de matière dans le tableau sont calculées pour les espèces présentes dans le bécher. On ne tient pas compte de la quantité de matière de réactif titrant dans la burette. On ne s'intéresse qu'à la quantité de B versé (avec
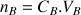 ).
).
Tableau d'avancement


On peut simplifier l'écriture d'un tableau d'avancement d'une réaction de titrage :
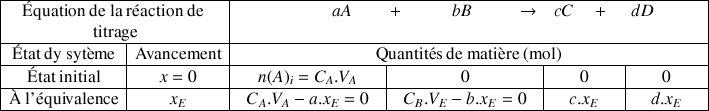
A l'équivalence les réactifs sont totalement consommés avec
Pour le réactif titré
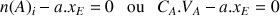
Pour le réactif titrant
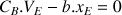
On en déduit les relations :
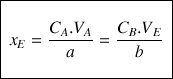
À l'équivalence la quantité de matière
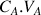 de réactif titré A divisée par le coefficient stœchiométrique a est égal à la quantité de matière
de réactif titré A divisée par le coefficient stœchiométrique a est égal à la quantité de matière
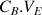 de réactif titrant versé à l'équivalence divisée par le coefficient stœchiométrique b.
de réactif titrant versé à l'équivalence divisée par le coefficient stœchiométrique b.
Fondamental :
Pour titrer une solution (déterminer la concentration en réactif titré) Il faut déterminer le volume d'équivalence
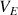 .
.
Il existe différentes méthodes pour déterminer
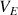 , elles vont être présentées dans la suite de ce cours.
, elles vont être présentées dans la suite de ce cours.






