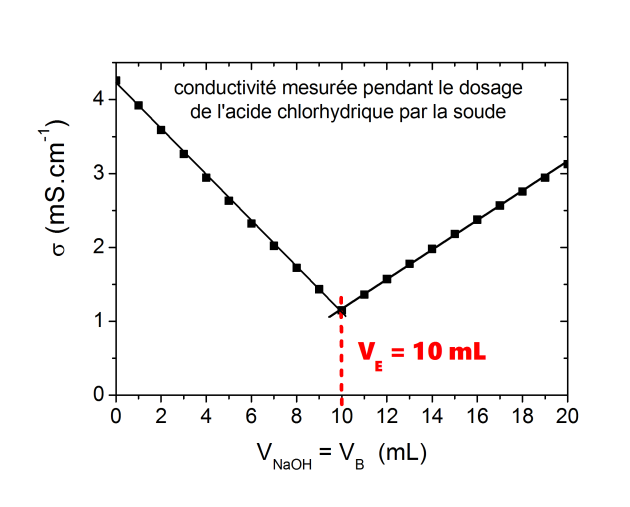Complément exemple 1
Exemple :
A partir de la mesure de la conductivité de la solution dans le bécher (voir exemple 1) on a déterminé la concentration de la solution d'acide chlorhydrique.
On va décrire plus précisément l'évolution de la conductivité de la solution dans le bécher au cours du titrage.
Attention :
Toutes les espèces sous forme d'ions contribuent à la conductivité de la solution. Pour cette réaction acido-basique les ions appelés généralement spectateurs (ils n'interviennent pas dans le bilan de la réaction) contribuent à la conductivité de la solution.
Exemple :
Au départ dans le bécher il y a de l'acide chlorhydrique :
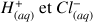
On verse à partir de la burette de la soude :
On calcule la conductivité à partir de la relation :
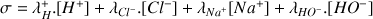
On notera pour simplifier l'expression :
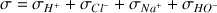
avec
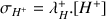
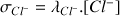
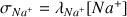
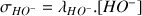
et :
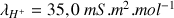
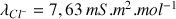
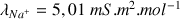
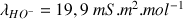
Remarque :
Pour simplifier la description de l'évolution de la conductivité de la solution au cours du titrage on considérera que le volume de la solution dans le bécher est constant (on néglige l'ajout du volume de soude).
Exemple :
 le réactif titré :
le réactif titré :
 (volume de soude versé) <
(volume de soude versé) <
 (volume versé à l'équivalence
(volume versé à l'équivalenceLes ions
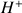 réagissent avec les ions
réagissent avec les ions
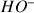 donc
donc
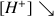 et
et
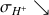
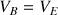
Les ions
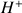 sont entièrement consommés donc
sont entièrement consommés donc
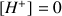 et
et
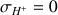
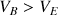
Il n'y a plus d'ions
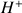 dans la solution donc
dans la solution donc
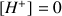 et
et
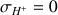
On peut observer l'évolution de
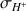 sur la figure ci-dessous
sur la figure ci-dessous
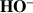 le réactif titrant :
le réactif titrant :
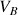 (volume de soude versé) <
(volume de soude versé) <
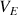 (volume versé à l'équivalence
(volume versé à l'équivalenceTous les ions
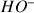 versés ont réagi avec des ions
versés ont réagi avec des ions
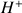 dans le bécher donc
dans le bécher donc
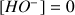 et
et
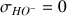
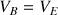
Tous les ions
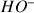 versés ont réagi avec tous les ions
versés ont réagi avec tous les ions
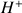 dans le bécher donc
dans le bécher donc
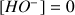 et
et
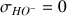
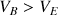
Il n'y a plus d'ions
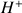 dans le bécher pour réagir dans les ions
dans le bécher pour réagir dans les ions
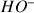 versés après l'équivalence donc
versés après l'équivalence donc
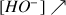 et
et
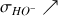
On peut observer l'évolution de
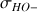 sur la figure ci-dessous
sur la figure ci-dessous
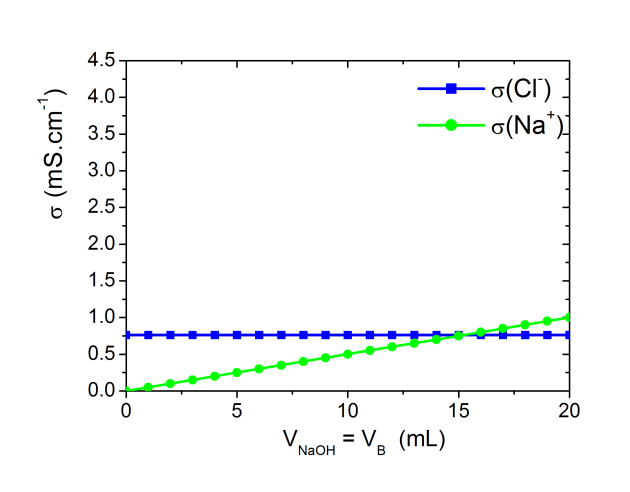
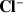 ion spectateur :
ion spectateur :
La quantité d'ions
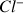 présents dans le bécher ne varie pas au cours du temps
présents dans le bécher ne varie pas au cours du temps
Donc pour toute valeur de
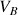 (volume de soude versé) on a
(volume de soude versé) on a
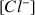 = constante et
= constante et
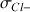 = constante
= constante
On peut observer l'évolution de
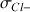 sur la figure ci-dessous.
sur la figure ci-dessous.
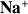 ion spectateur :
ion spectateur :
La quantité d'ions
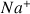 dans le bécher augmente avec le volume de soude versé
dans le bécher augmente avec le volume de soude versé
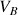 donc on a
donc on a
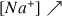 et
et
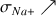
On peut observer l'évolution de
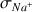 sur la figure ci-dessous.
sur la figure ci-dessous.
Les pentes des droites pour les différentes contributions
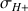 ,
,
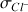 ,
,
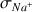 et
et
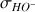 à la conductivité totale
à la conductivité totale
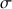 sont directement proportionnelles aux conductivités molaires ioniques
sont directement proportionnelles aux conductivités molaires ioniques
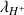 ,
,
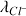 ,
,
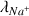 et
et
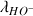 .
.
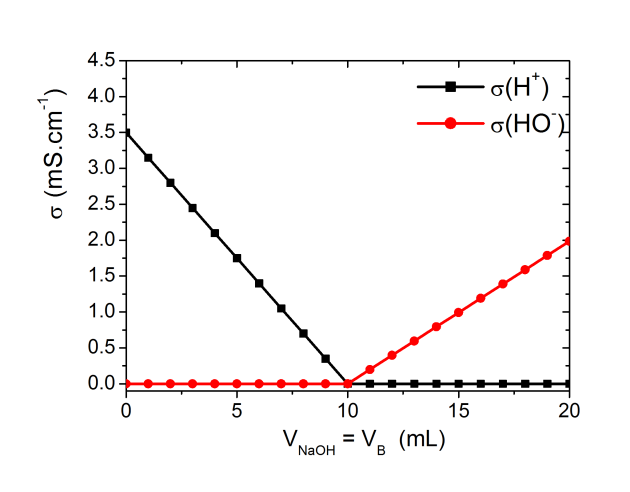
D'après les valeurs de
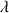 (voir ci-dessous) la disparition des ions
(voir ci-dessous) la disparition des ions
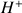 au cours du titrage va entraîner une forte diminution de la conductivité totale qui ne sera pas compensée par l'ajout d'ions
au cours du titrage va entraîner une forte diminution de la conductivité totale qui ne sera pas compensée par l'ajout d'ions
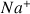 dans la solution (
dans la solution (
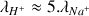 ). Après l'équivalence la conductivité augmente de nouveau très fortement grâce à l'ajout des ions
). Après l'équivalence la conductivité augmente de nouveau très fortement grâce à l'ajout des ions
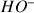 .
.
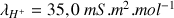
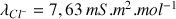
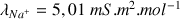
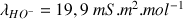
Évolution de la conductivité globale
 :
: