3. Les interactions dipolaires
Lorsque des atomes liés ont des électronégativités différentes, on observe la formation d'un moment dipolaire entre eux.
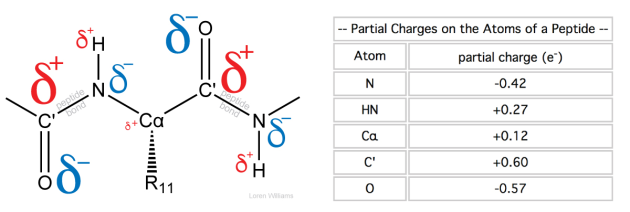
Les moment dipolaires interagissent les uns avec les autres entre les molécules et dictent leur orientations respectives. Les différences de polarité entre les atomes sont aussi à l'origine de charges partielles sur les atomes, comme dans la Figure 3.
Un moment dipolaire, ou les charges partielles associées créent des forces d'attraction ou de répulsions.
3.1 Interactions dipôle-dipôle (interactions de Keesom)
Définition :
Les interactions de Keesom tirent leur origine de l'interaction entre les moment dipolaires de molécules.
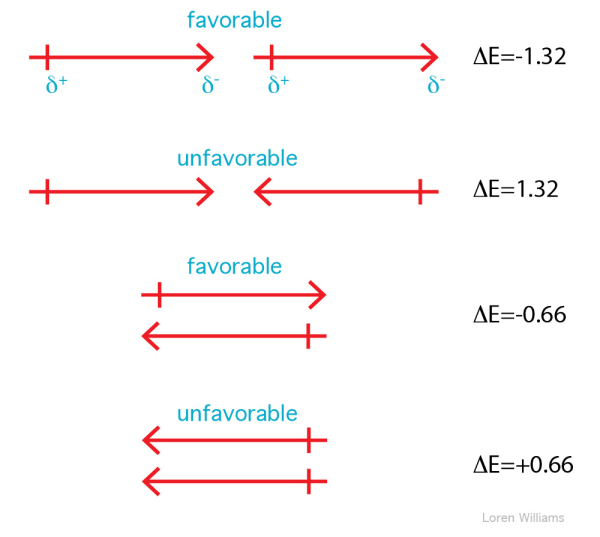
La Figure 4 regroupe les différents type d'interactions dipolaires.
3.2 Interactions dipole-dipole induit (interactions de Debye)
Définition :
Une interaction de Debye tire son origine de l'interaction entre une molécule polaire et le moment dipolaire induit qui est créé par le champ électrique de la première molécule sur la seconde.
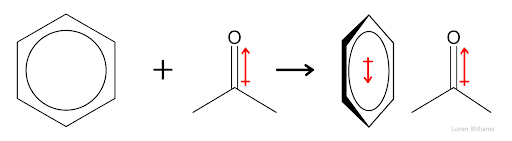
Lorsqu'une molécule polaire s'approche d'une autre molécule qui porte des charges partielles, on observe une polarisation de la première. Les électrons de la première molécules se réorganisent pour s'adapter au champ électrique qu'ils perçoivent. Cette polarisation disparaît si on éloigne les deux molécules.
3.3 Interactions charge - dipôle
Définition :
Les interactions charge-dipôle tirent leur origine des interactions électrostatiques entre des particules chargées et les charges partielles de molécules polaires, comme illustré sur la Figure 6.

3.4 Interaction entre dipôles instantanés (forces de London)
A chaque instant, lors du mouvement des électrons dans une molécules, des moment dipolaires se créent et puis s'annulent. Un atome de xénon par exemple est bien sûr en moyenne sphérique, mais la forme de son nuage électronique varie pourtant à chaque instant.
A chaque instant, 2 molécules, même apolaires, créent pourtant des interactions dues à leurs moment dipolaires furtifs et fluctuants, comme montré sur la Figure 7. Ces interactions sont toujours attractives. Elles varient en 1/r6 , r étant la distance entre les particules.