1. Les interactions de répulsion à courte distance, ou van der Waals
Les atomes prennent de la place dans l'espace. On ne peut pas les superposer. Lorsqu'on les rapproche, les orbitales atomiques se repoussent avec des forces électrostatiques. Ces forces ont des portées très courtes dans l'espace. Cette énergie de répulsion varie comme (d/R)12, où R est la distance entre les atomes et d'une distance en dessous de laquelle l'énergie devient répulsive. d dépend du type d'atome, on parle de rayon de van der Waals. lorsque deux atomes s'approchent, ce terme est faiblement attractif tant que la distance R entre les atomes est supérieure à d. Plus près, ce terme devient fortement répulsif.
Exemple :
Par exemple, si on admet qu'on ne forme pas de liaison chimique, un atome de Carbone (d = 1,7 Å) et un atome de Soufre (d = 1,8 Å) ne peuvent pas s'approcher à moins de 1,7 + 1,8 = 3,5 Å.
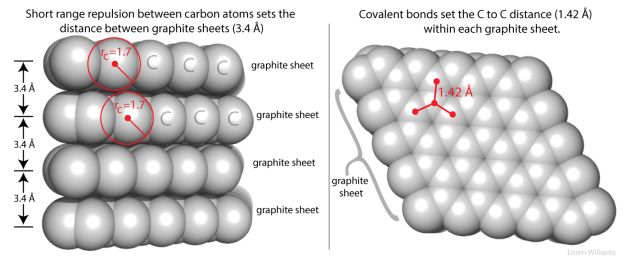
Dans le carbone graphite, on identifie deux type d'interactions. Les atomes des feuillets se touchent avec des distance de 1,7 x 2 = 3,4 Å. Dans le cas de systèmes avec des liaisons covalente, cette distance est plus faible (d = 1,42 Å) car les orbitales moléculaires sont formées, voir la Figure 1.