8.3.5- Induction par défaut
On entend par induction par défaut, la destinée que prend l'ectoderme soumis à aucune interaction car en fonction de son environnement, l'ectoderme peut évoluer selon 2 possibilités (Fig.239).

Soit il n'interagit pas avec l'organisateur et BMP4 oriente l'ectoderme vers la différenciation épidermique caractérisée par un aplatissement de l'épithélium et l'expression de la kératine. BMP4 apparaît ainsi comme un inducteur autocrine, lorsqu'il est exprimé par l'ectoderme. Soit BMP4 est inhibé par Noggin (Fig.240), Chordin ou Follistatin, et dans ce cas l'ectoderme se neuralise.

En somme, la neuralisation s'effectue par différence avec la détermination épidermique. On appelle ce type d'induction une induction par défaut.
Une expérience de microinjection montre le rôle de Chordin et de BMP4 dans le choix que prend l'ectoderme pour donner soit de l'épiderme, soit du neuroderme (Fig.241).

Des ARNm codant pour Chordin sont injectés dans un œuf fécondé. Lorsque l'embryon est parvenu au stade blastula, la calotte ectodermique est prélevée et mise en culture.
L'expérience est alors divisée en trois lots. Dans le premier, on laisse évoluer les explants de calotte ectodermique.
Dans le deuxième on ajoute dans le milieu de culture, la protéine BMP4 à la concentration de 1nmol L-1. Enfin dans le troisième lot, on ajoute à nouveau la protéine BMP4 à la concentration de 10nM.
Les résultats montrent qu'en culture isolée, l'ectoderme seul exprime la N-CAM et est donc sur la voie de la neurulisation. Si on ajoute BMP4 à la concentration de 1nmol L-1, on obtient un mélange d'expression neurale (N-CAM) et épidermique (kératine).
Enfin si on rajoute BMP4 à la concentration de 10nmol L-1, on rétablit la destinée épidermique des cellules ectodermiques.
C'est ainsi que l'on peut définir l'induction neurale par défaut. D'une manière générale, BMP4 maintient un rôle ventralisant dans l'ensemble de l'embryon. Dès que l'organisateur est induit, il produit des molécules diffusibles qui reconnaissent BMP4, s'y lie et inhibe sa fonction dans l'environnement immédiat, c'est à dire la région dorsale.
En conséquence, comme pour la dorsalisation, l'induction neurale dépend de signaux provenant de l'organisateur (Fig.242). On considère que BMP4 est présent de manière ubiquitaire dans l'ensemble de l'embryon. Dès que l'organisateur de Spemann est induit par le centre de Nieuwkoop, il secrète les molécules diffusibles antagonistes de BMP4 qui diffusent dans toutes les directions. Au voisinage de l'organisateur, l'inhibition de BMP4 modifie la destinée des tissus.
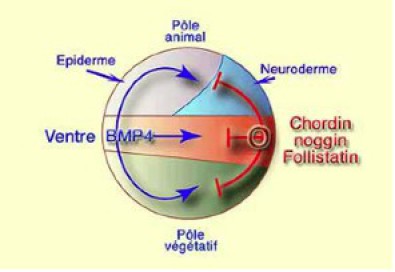
Dans le mésoderme de la zone marginale, c'est la dorsalisation. Dans l'ectoderme c'est la neuralisation. Les molécules antagonistes sont les mêmes dans les deux cas , Noggin, Chordin et Follistatin qui agissent selon les mécanismes que nous avons analysés précédemment. Seule la réponse diffère selon l'origine des tissus (Fig.243).

Ainsi, les expériences de ventralisation par BMP4 et de restauration par Noggin et Chordin prennent tout leur sens puisqu'elles concernent à la fois la détermination du mésoderme latéroventral et l'induction neurale (Fig.244).

Ce système est dynamique au point qu'à chaque instant les interactions cellulaires sont modifiées par les mouvements cellulaires de la gastrulation (Fig.245).

Ainsi, l'organisateur s'invagine, s'allonge dans le sens antéropostérieur et converge vers le plan médian. Les interactions se restreignent donc dans la région dorsale, le long et de part et d'autre de l'axe médian. Le signal transversal transmis par l'organisateur vers l'ectoderme dorsal est matérialisé par les molécules diffusibles Chordin, Noggin et Follistatin. Par contre, le signal planaire n'a pas besoin des mouvements d'invagination pour s ‘exercer puisqu'il transite dans le plan du tissu à partir de la lèvre dorsale du blastopore tout au long de la gastrulation. L'organisateur s'invagine donc en commençant par les tissus à vocation antérieure et en finissant par les tissus postérieurs (Fig.246).

Le signal planaire apparaît ainsi comme un modulateur de l'induction neurale en imposant une régionalisation antéropostérieure de la neuralisation. L'expression de gènes régionaux oriente la détermination des grandes régions du système nerveux. Ce sont Engrailed 2 pour le cerveau intermédiaire. Krox2 pour
Le rhombencéphale et XoxB9 (XLHBox6) pour la moelle épinière.
Ajoutons à cela l'existence d'un gradient antéropostérieur d'acide rétinoïque qui postériorise les tissus de l'embryon. L'augmentation expérimentale de la concentration en l'acide rétinoique dans le milieu provoque la disparition des structures antérieures (Fig.247).







