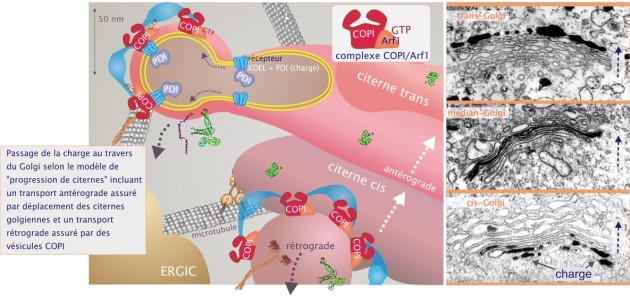
Passage de la charge au travers du Golgi : transport rétrograde par des vésicules COPI
Ce transport rétrograde, réalisé par des vésicules tapissées COPI (coat proteins type I) est présent à tout niveau de l'empilement golgien. La formation de vésicules COPI s'effectue comme celle de vésicules COPII. L'assemblage du manteau est initié par Arf1, qui lorsqu'elle est liée au GTP recrute deux complexes protéiques (« coatomer ») : complexe F composé de COP–\(\beta,\delta,\gamma\) et \( \zeta \)et complexe B, composé de COP–\(\alpha,\beta'\) et \(\varepsilon\). Certains composants de COPI agissent comme des récepteurs mais les motifs qu'ils reconnaissent demeurent peu connus. Le manteau en construction recrute à son tour les Q–SNAREs (syntaxine–5 (+rSly), membrine, Rbet) et la R–SNARE (Sec22b), les protéines d'arrimage, les protéines accessoires de fusion et la GTPase Rab1. Au fur et à mesure de l'augmentation de sphéricité de la vésicule, Arf1 est hydrolysé, entraînant la perte du manteau et rendant la vésicule dénudée prête à la fusion avec le compartiment précédent (voir figure 23, et cliquez sur la loupe sous la figure pour plus de détails).
i pour plus de détail sur le complexe COPI.
Le transport rétrograde atteint également le REr de façon à compenser la perte de membrane consécutive au mouvement antérograde et à retourner vers le REr la charge protéique qui lui est spécifique. Trois protéines sont particulièrement concernées : la disulfure isomérase PDI, la protéine chaperonne BiP et le récepteur des glycoprotéines ERGIC–53. On sait que COP–\(\alpha\) reconnaît le motif dilysine (KKxx or KxKxx) présent : 1/ dans le récepteur KDEL, qui lui-même fixe les protéines solubles BiP et PDI, et 2/ dans ERGIC–53, protéine membranaire. Par le transport antérograde et rétrograde ces protéines font l'objet d'une navette entre le REr et le Golgi. Enfin, le transport rétrograde sert aussi à éliminer les protéines « usées » du Golgi qui, une fois arrivées dans le REr, sont dirigées vers le canal de translocation en direction des protéasomes.
Complément : Excursion : courbure membranaire et hydrolyse du GTP lié à Arf1
Le développement du manteau est un processus dynamique d'environ une minute au cours duquel les nombreuses protéines s'assemblent puis, une fois la vésicule formée, se séparent pour que le processus subséquent de fusion puisse se dérouler (avec d'autres vésicules, la membrane plasmique etc.)
L'assemblage du manteau COPI survient lorsqu'Arf1 est chargé en GTP, un stade actif qui orchestre le recrutement de sept composants du manteau (COP–\(\rm \alpha,\beta,\beta',\gamma,\delta,\varepsilon\ et\ \zeta\)) mais aussi de la protéine d'activation d'ArfGTPase (ArfGAP) qui facilite l'hydrolyse de GTP, désassemblant ainsi le manteau. Le moment où Arf1 est inactivé est crucial pour le bon déroulement du processus : une hydrolyse prématurée empêche la courbure de se faire et, au contraire, une hydrolyse trop tardive contrarie la fusion. Une étude récente a montré que la courbure membranaire induite par le manteau constitue le signal d'inactivation d'Arf1. Lorsque la densité lipidique du feuillet externe décroît, en raison de la courbure progressive de la membrane, ArfGAP interagit avec Arf1 en hydrolysant son GTP et le complexe du manteau se disloque.
![]() Pour en savoir plus, consultez le document suivant : « Coat dissassembly by ArfGAP » [pdf] (324 Ko).
Pour en savoir plus, consultez le document suivant : « Coat dissassembly by ArfGAP » [pdf] (324 Ko).
Remarque : Les algues à écailles et le modèle de la « maturation des citernes »
Chrysochromulina chiton est une algue microscopique (0,5-2,0 \(\mu m\)) du groupe des prymnésiophytes dont le tégument est couvert de plusieurs couches d'écailles protéiques. Ces écailles sont élaborées dans l'appareil de Golgi, positionné à la base du flagelle. Des études menées en 1967 par une pionnière de la microscopie électronique, Irene Manton (Université de Leeds, Royaume Uni), ont illustré le modèle de la maturation des citernes. Les images montrèrent la présence d'écailles partiellement assemblées dans les citernes cis et d'écailles matures dans les citernes en position trans terminale. Aucune écaille n'a été observée dans des vésicules de transport suggérant que ce sont les citernes elles-mêmes (avec leur contenu) qui progressent dans le sens cis trans.
Article : I. Manton. Further observations on the fine structure of Chrysochromulina chiton with special reference to the haptonema, « peculiar » Golgi structure and scale production. J Cell Sci 1967, 2: 265-272.