Les cathepsines
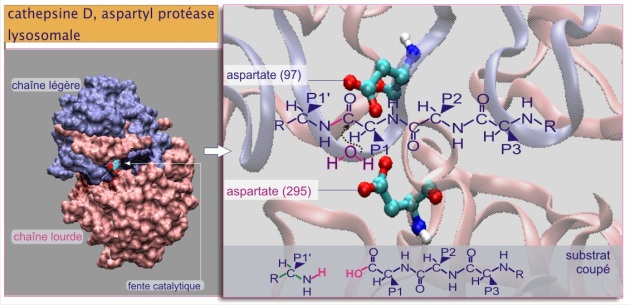
Les cathepsines sont des protéases qui tiennent une place importante dans la dégradation des protéines par le lysosome. Elles forment une famille d'au moins onze membres, appelées cathepsine A, C, D, F, H, J, K, L, L2, S et Z. Dans leur portion glucidique, elles portent toutes un mannose–6–phosphate, le « glucide-de-destination » pour les enzymes lysosomales. Elles sont généralement formées de deux chaînes polypeptidiques (clivage post-traductionnel) solidarisées par des ponts disulfures (figure 26). Elle gagnent les lysosomes sous une forme de pro-enzyme et ne deviennent protéases actives qu'après l'élimination de 40 à 50 résidus amino acidiques de leur région N–terminale et l'établissement d'un environnement acide (pH 4-5). Un membre de la famille, la cathepsine D est une aspartyl protéase (comme la pepsine, enzyme digestive), caractérisée par deux résidus aspartate constituant le site actif (voir figure 26 et cliquer sur la loupe pour plus de détails sur cathepsine D). En dehors de son rôle dans l'entretien du contenu protéique des endosomes tardifs, elle joue aussi un rôle capital dans la présentation de peptides au complexe majeur d'histocompatibilité type II (présentation de l'antigène aux cellules compétentes du système immunitaire). Sa production excessive est associée à la dystrophie musculaire et à l'apparition des métastases cancéreuses.