ARNt
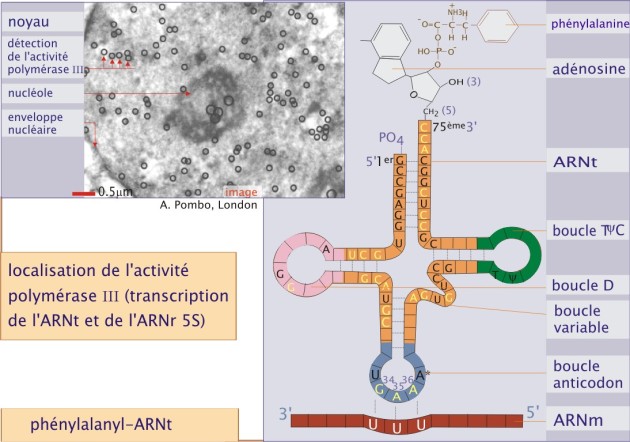
Le code est déchiffré par les ARN de transfert (ARNt) selon le principe de reconnaissance complémentaire codon - anticodon. En effet l'ARNt possède une séquence de trois nucléotides (« trois lettres ») complémentaires du codon, c'est l'anticodon, qui s'appariera avec lui. Chaque ARNt est spécifiquement lié à un acide aminé précis. Par conséquent chaque codon de l'ARNm appellera un acide aminé spécifique qui se liera au précédent : c'est la traduction du gène. Dans l'exemple de la figure 7, l'ARNtPhe est présenté de façon simplifiée selon le classique modèle en feuille de trèfle permettant de montrer la position de l'anticodon, le site de fixation de la phénylalanine (Phe), les nucléotides impliqués dans l'interaction avec la phénylalanyl–ARNt–synthétase (lettres en jaune) et, enfin, les nucléotides impliqués dans l'appariement intramoléculaire (liaison en pointillé).
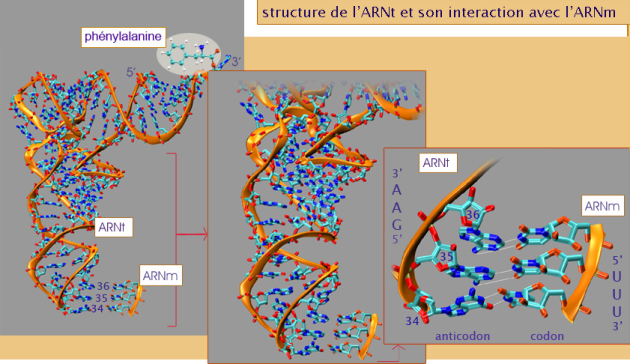
Cette règle de complémentarité s'applique strictement au codon 5' - AUG - 3' qui est reconnu par l'ARNt portant l'anticodon 3' - UAC - 5' ; cet ARNt liant de façon covalente et spécifique l'acide aminé méthionine. Cependant, certains ARNt peuvent reconnaître plusieurs codons car la complémentarité entre les nucléotides occupant la troisième place dans le triplet, n'est pas stricte (« wobble position »). Par exemple l'ARNt-alanine reconnaît les codons (5 '--> 3') GCA, GCC et GCU alors que, selon la règle de complémentarité stricte du modèle de Watson et Crick, ces séquences ne devraient s'apparier qu'avec les anticodons (3' --> 5') CGU, CGG et CGA, respectivement. Or l'anticodon de l'alanine s'avère être (3' --> 5') CGI (inosine) et ce sont les propriétés chimiques de l'inosine qui expliquent que cette base particulière peut s'apparier indifféremment avec U, C ou A (). La figure 8 montre en détail l'appariement de l'ARNt de la phénylalanine, anticodon 5' - GAA - 3', avec l'un des deux codons qui existent pour cet acide aminé 3' - UUU - 5' (l'autre codon est 3' - CUU - 5' sur l'ARNm).
Remarque :
Pour plus d'information sur des gènes codant des ARNt du génome humaine et les anticodons qu'ils portent, .
Chaque ARNt est codé par un gène. Au total il existe 47 ARNt différents, transcrits par l' ARN polymérase–III dans le nucléoplasme. Le transcrit primaire est fortement modifié. Parmi ces modifications post-transcriptionnelles, on trouve :
1/ l'enlèvement de séquences de bases des cotés 5' et 3' (respectivement par la RNAse P et une endonucléase),
2/ l'addition d'une séquence CCA à l'extrémité 3' par une nucléotidyl transférase (site de liaison covalente à l'acide aminé) et
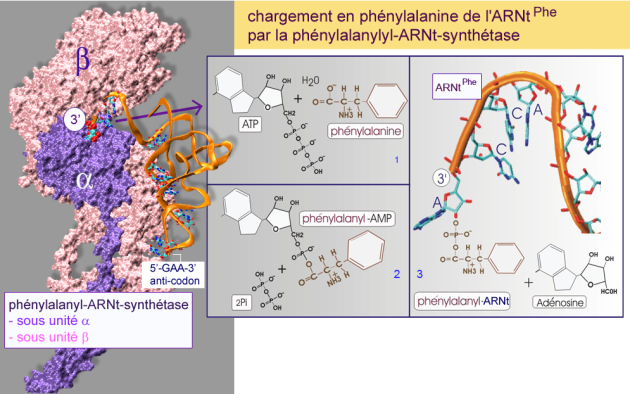
3/ plusieurs modifications de nucléotides telles que la transformation de certaines guanosines en méthylguanosines ou de certaines adénosines en 2–méthylthio–N6–thréonylcarbobamyladénosines. Ces modifications jouent un rôle important dans l'appariement anticodon - codon et l'interaction de l'ARNt avec son aminoacyl - ARNt synthétase, l'enzyme qui permet de lier spécifiquement un acide aminé. La liaison entre l'ARNt et son aminoacyl - ARNt synthétase associée, est hautement spécifique et implique plusieurs régions de l'enzyme et de l' ARNt. Ceci a pour but d'éviter des erreurs dans la traduction (une erreur sur 2000 liaisons). La figure 9 montre les nombreux nucléotides (en bleu et rouge) de l'ARNtPhe impliqués dans l'interaction avec la phénylalanyl-ARNt-synthétase.
Dans les cas où plusieurs codons traduisent un même acide aminé (code « dégénéré »), plusieurs ARNt (chacun avec un anticodon différent) seront porteurs du même acide aminé. Etant donné qu'il n'existe que 20 ARNt synthétases (pour 20 acides aminés), ceci revient à dire, que plusieurs ARNt interagissent avec la même ARNt synthétase. La liaison covalente entre ARNt et acide aminé nécessite l'hydrolyse de l'ATP (voir figure 9).