Phosphorylation oxydative liée à la chaîne de transport des électrons
La chaîne de transport des électrons
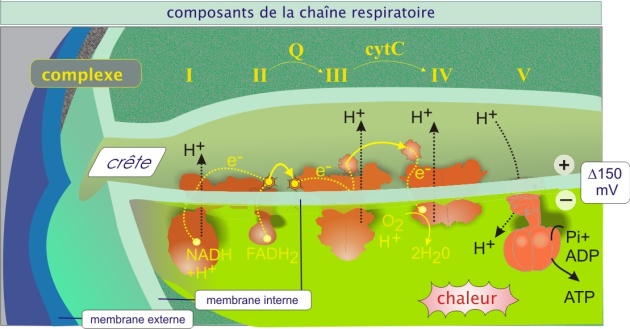
Les hydrogènes (électrons plus protons) captés par le NAD+ (qui devient le NADH + H+), issus de la dégradation des molécules de glucose et d'acide gras sont transférés à l' O2 grâce à une série d'événements qui aboutit à la formation d'H2O : la chaîne de transport des électrons. Cette chaîne se déroule dans la membrane interne de la mitochondrie, surtout dans les crêtes, et elle fait intervenir plusieurs complexes enzymatiques, appelés : NADH-quinone oxydoréductase (complexe I), succinate-quinone oxydoréductase (complexe II), Quinol-cytochrome c oxydoréductase (complexe III ou complexe bc1) et Cytochrome c oxydase (complexe IV).
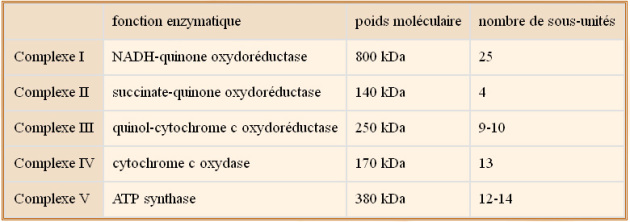
Elle contient également 1) l'ubiquinone, qui se trouve dans l'épaisseur de la membrane interne (molécule lipophile), qui transporte les électrons (et protons) du complexe II au complexe III, et 2) le cytochrome c, qui se trouve dans l'espace inter membranaire et qui établit une navette d'électrons entre complexes III et IV. Les événements sont présentés schématiquement figure 11. Dans cette image, les complexes sont représentés en une seule entité mais en réalité ils sont constitués de plusieurs sous-unités protéiques. Le tableau ci-dessous donne une idée de la taille et de l'hétérogénéité des complexes de la chaîne respiratoire.
![]() Pour plus d'information sur la composition des protéines de la chaîne respiratoire et leur arrangement dans des super complexes, consultez le document suivant :
Pour plus d'information sur la composition des protéines de la chaîne respiratoire et leur arrangement dans des super complexes, consultez le document suivant :
« Supercomplexes dans la chaine respiratoire de la mitochondrie 2010_Boekema [pdf] » (pdf 1 Mo).
Animation : cette animation montre comment le passage des électrons, de cytochrome c à cytochrome c oxydase (complexe IV), permet le transport simultané de protons (H+) à travers la membrane interne de la mitochondrie (fonction de pompe de la cytochrome c oxydase)
Macromedia Shockwave - 106Ko
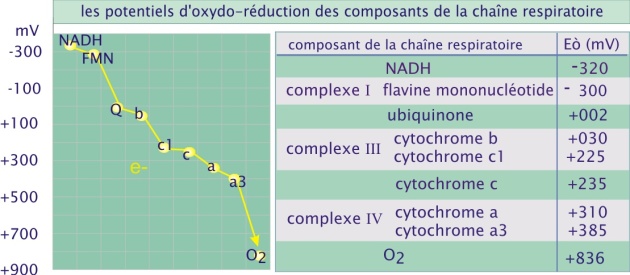
La direction du flux d'électrons le long de la chaîne de transport est déterminée par la faculté des composants à perdre ou à gagner des électrons. Par exemple, NAD+ a une affinité modérée pour les électrons, si bien que sa forme réduite, NADH(+H+), peut facilement céder ses deux électrons. Au contraire, l'oxygène moléculaire a une très forte affinité pour les électrons et est donc un très bon agent oxydant, capable de capturer avidement les électrons des autres molécules. La capacité à « donner » ou à « prendre » des électrons est exprimée par un paramètre nommé potentiel d'oxydoréduction (symbole Eò), NAD+ ayant un potentiel de -320mV et l'oxygène moléculaire, un potentiel de +816mV. Les électrons se déplacent des molécules à faible potentiel d'oxydoréduction vers les molécules possédant un potentiel fort ; et donc dans le cas de la chaîne mitochondriale de transport des électrons, du NADH à l'oxygène moléculaire (voir figure 12).
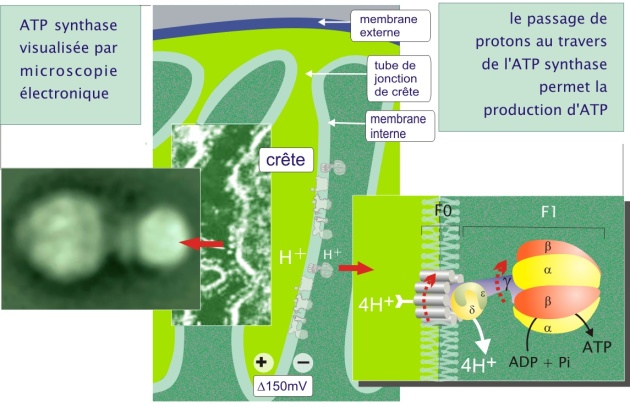
Fondamentalement, au cours de la capture des électrons par les complexes I, III et IV, il y a simultanément translocation des protons vers l'espace inter membranaire (pompe H+) (voir figure 11 et son animation). Le processus crée un gradient protonique (potentiel membranaire de 150 mV, négatif côté espace matriciel et une différence de pH de 0,5). Le gradient électrochimique ainsi généré est utilisé pour la phosphorylation de l'ADP en ATP par l'ATP synthase (complexe V, qui constitue une particule dite élémentaire visible en microscopie électronique) (voir figure 13). Le couplage de l'oxydation des métabolites en CO2 et H2O et la production d'ATP est appelé phosphorylation oxydative.
Remarque : Hébergement des électrons dans les composants de la chaîne
Au sein de la chaîne de transport, les électrons sont successivement et transitoirement « hébergés » par différents sites moléculaires appelés groupes prosthétiques (porphyrines et flavine mononucléotides (FMN, apportée par la vitamine « riboflavine B2 »). Les atomes qui hébergent les électrons dans ces groupes prosthétiques peuvent être : des atomes de C ou N, pour NAD+ (apporté par la « vitamine B3 » (acide nicotinique) et ubiquinone ; des atomes de Fe inclus dans une structure moléculaire appelée hème ou hémochrome, pour les cytochromes ; des complexes de Fe.S, pour les FMN et cytochrome bc1 ; des atomes de Cu dans la cytochrome c oxydase. Cette ressource n'a pas pour but d'exposer en détail l'aspect biochimique et biophysique de la phosphorylation oxydative. Pour information complémentaire sur le sujet, nous vous suggérons de consulter « La biochimie, Tome 1 :biochimie structurale et métabolique, Christian Moussard, De Boeck Université »
Remarque : Etymologie des termes cytochrome et ubiquinone
Les cytochromes sont des pigments cellulaires (chromos = couleur) détectables dans l'intervalle 300 à 600 nm du spectre de la lumière. Le terme désigne un ensemble formé d'une protéine et d'un groupe prosthétique (hémochrome) responsable de l'absorption caractéristique de la lumière.
Ubiquinone, nommée pour sa répartition très large, ubiquitaire, chez les végétaux, animaux et micro-organismes (latin ubique = présent partout). Elle fut identifiée plus tard à un co-enzyme de la chaîne respiratoire, nommé pour cela co-enzyme Q10 (ubiQuinone). 10 fait référence au nombre d'unités isopréniques (CH2- CH = C - (CH3) - CH2) présentes dans la queue hydrophobe de la molécule (située dans la membrane).
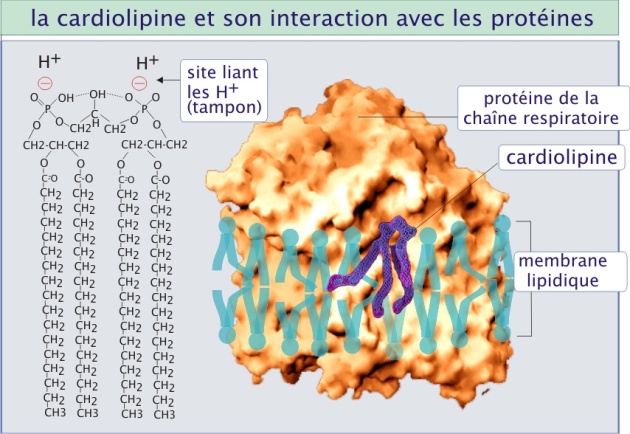
Cardiolipine et chaîne respiratoire
La cardiolipine, ou diphosphatidylglycérol, est un lipide qui est spécifique des membranes des bactéries et des mitochondries, autrement dit, des membranes dont la fonction est de fournir un potentiel électrochimique pour le transport des électrons et la synthèse d'ATP . Le terme cardiolipine vient du fait que ce lipide a été isolé à partir de cœur de bovin dans lequel il représente 10% des phospholipides totaux. Plus tard, la cardiolipine a été trouvée en abondance dans la mitochondrie où elle représente 20% des phospholipides totaux et dans la membrane externe des bactéries. Etant donné que la cardiolipine est un lipide spécifique de la mitochondrie on est en droit de penser que sa fonction biologique dans cet organite, est fondamentale. Elle est localisée principalement dans la membrane interne où elle interagit avec plusieurs protéines parmi lesquelles les complexes III (cytochrome bc1) et IV (cytochrome c oxydase), la protéine d'échange ATP/ADP, l'ATP synthase et le transporteur de phosphate inorganique (Pi). Il a été montré que la cardiolipine déterminait la structure quaternaire (et donc fonctionnelle) de ces protéines enzymatiques et assurait également la bonne orientation et la bonne position (pour faciliter le passage des électrons) des différents composants de la chaîne respiratoire. Ce rôle est bien illustré par le syndrome de Barth, myopathie spécifique due à une production défectueuse de cardiolipine résultant en un fort déficit dans la production d'ATP . La cardiolipine limite aussi la diffusion de protons situés dans l'espace inter membranaire en les liant à ses groupes phosphates, tamponnant ainsi le pH global (voir figure 14). Enfin, la cardiolipine est considérée comme un co-facteur déterminant de l'importation du cholestérol indispensable au déroulement de la stéroïdogenèse mitochondriale.
L'ATP synthase (F0F1)
En présence du gradient de protons établi entre les deux faces de la membrane mitochondriale interne et en absence de concentrations élevées d'ATP dans la matrice, l'ATP synthase laisse passer les protons, au niveau du domaine membranaire F0, un passage qui permet la production d'ATP par le domaine F1. Plus précisément, chaque sous-unité \(\alpha\), du domaine F1 de la protéine, couple rapidement l'ATP et le Pi en produisant l'ATP qui reste en place. C'est le potentiel de membrane et le passage des protons qui en résulte (« source d'énergie »), qui permet l'expulsion de l'ATP vers l'espace matriciel au cours d'un mouvement de rotation de la sous-unité \(\gamma\) dans le domaine F1. La place de l'ATP est immédiatement prise par un nouvel ADP + Pi. Il faut 12 protons pour la production de 3 ATP (voir figure 13 ci-dessus).
Cette enzyme peut également fonctionner dans l'autre sens, ce qui se produit en absence de gradient de protons et en présence d'ATP . Dans ce cas elle fonctionne comme une pompe à protons, comparable à l'H+-ATPase de la membrane des lysosomes décrite dans la ressource « ».
Bilan final
Le bilan final de toutes ces inter conversions chimiques, c'est que l'oxydation complète d'une molécule de glucose fournira 30 molécules d'ATP et qu'une molécule d'acide gras, tel que le palmitate (C16), fournira 120 molécules d'ATP. La complexité des inter conversions chimiques qui s'effectuent dans les mitochondries trouve sa justification dans un phénomène de fractionnement de l'énergie libérée qui évite un dégagement excessif de chaleur dû à la condensation de 2H2 et O2 (en 2H2O). L'énergie peut être convertie efficacement en liaisons riches en énergie dans des molécules telles que l'ATP grâce à des réactions couplées.
Remarque : La théorie de chimiosmose
Le processus précédemment décrit est analogue à un générateur faisant passer un courant à travers une série de moteurs électriques. Cependant, dans les systèmes biologiques, les électrons sont transportés d'un site à l'autre par des molécules diffusibles qui prennent des électrons au niveau d'un site pour les apporter sur un autre site. Dans le cas de la chaîne mitochondriale de transfert d'électrons, le processus commence avec le NADH (+H+).
C'est l'anglais Peter Mitchell qui proposa le mécanisme de couplage entre le transport des électrons et la synthèse de l'ATP . Il suggéra que le flux des électrons d'un composant à l'autre de la chaîne respiratoire (et ceci est également vrai pour le flux des électrons dans les photo systèmes du chloroplaste) dirige des protons (ions hydrogène) au travers de la membrane (vers l'espace inter membranaire), créant ainsi un gradient protonique (150 mV). Secondairement, la production d'ATP est due au flux inverse de protons descendant le gradient. Cette proposition constitue la base de la théorie appelée chimiosmose (Mitchell, prix Nobel en 1978).
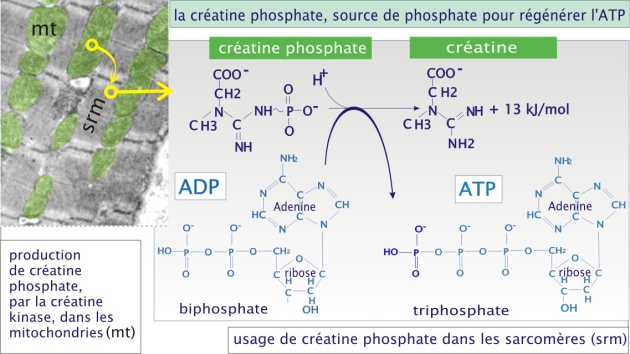
Remarque : Créatine phosphate
Bien que la production d'ATP soit essentiellement due aux processus métaboliques décrits plus haut, la mitochondrie peut utiliser une voie alternative pour assurer la production immédiate d'ATP . Elle possède en effet une enzyme, créatine kinase, qui catalyse la production de créatine-phosphate. Celle-ci est à son tour transportée dans le cytoplasme où elle est utilisée pour phosphoryler l'ADP en ATP (régénération très rapide de l'ATP , indépendante de la production d'ATP mitochondrial) (voir figure 15). Cette voie s'épuise en environ 8 secondes dans le muscle au travail et pourrait donc être vue comme un processus tampon entre la demande immédiate et la possibilité de production par la glycolyse et la chaîne respiratoire.
La créatine est un additif nutritionnel populaire chez les athlètes dont la spécialité sportive nécessite un apport brutal d'énergie (par exemple, sprinters et haltérophiles). L'idée de départ est d'atteindre un haut niveau de créatine-phosphate et donc d'atteindre une production plus élevée d'ATP dans les 8 premières secondes. Cependant, il n'y a pas de preuve établie que cette supplémentation artificielle augmente le niveau cellulaire de créatine phosphate et donc augmente réellement les possibilités de l'athlète. La figure 16 présente l'usage de différentes sources d'énergie utilisées pour l'approvisionnement en ATP pendant un exercice physique.