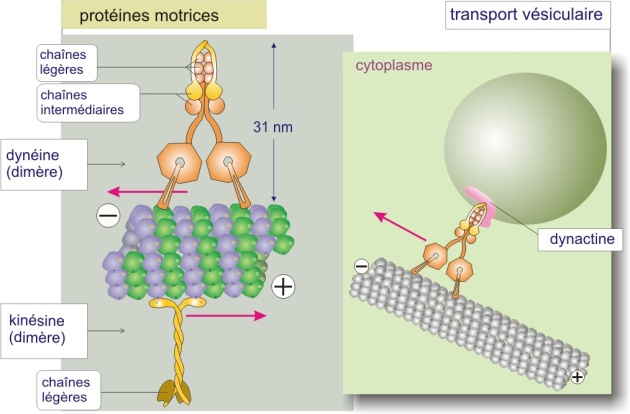
Protéines motrices interagissant avec les microtubules
De même que la myosine-II interagit avec l'actine pour engendrer le mouvement, deux familles de protéines « motrices » interagissent avec les microtubules. Ce sont les kinésines (130 kDa) qui se déplacent vers l'extrémité plus du microtubule et les dynéines (540 kDa), qui se déplacent vers l'extrémité moins (en direction du centrosome) (figure 24 ci-dessous). Ces protéines motrices sont toujours associées à d'autres protéines. La kinésine est associée à une chaîne protéique légère (de 64 kDa) qui lui permet de fixer les organites cellulaires à transporter (voir « mouvement des organites le long des microtubules », page suivante). La dynéine est emballée dans un complexe protéique constitué de six chaînes intermédiaires (de 53 à 80 kDa) et de six chaînes légères (de 8 à 22 kDa). Ce complexe permet aussi de fixer les organites. Comme la myosine-II, les protéines motrices utilisent l'énergie dérivée de cycles répétés d'hydrolyse de l'ATP pour se déplacer le long du microtubule.
![]() Animation : cette animation (commentée en anglais) montre le mouvement de la kinésine à la surface d'un microtubule [réalisation Graham Johnson pour Garland Press]
Animation : cette animation (commentée en anglais) montre le mouvement de la kinésine à la surface d'un microtubule [réalisation Graham Johnson pour Garland Press]
Apple Quicktime - 4,32Mo
Les kinésines sont des homodimères dans lesquels les deux molécules sont enroulées côté queue, laissant libre leurs têtes (domaine moteur) (revoir aussi , figure 4 de cette ressource).
Ces dimères se déplacent à la surface du microtubule (en se fixant uniquement à la -tubuline) comme on marche sur les pierres d'un passage à gué : les deux têtes de kinésine se fixent tour à tour en effectuant à chaque fois un mouvement de semi-rotation, ce qui se traduit par une progression du dimère le long du microtubule. Le mécanisme de déplacement de la dynéine n'est pas encore élucidé.
Remarque : Détail de l'interaction entre kinésine et tubuline
L'interaction kinésine/tubuline est connue : le domaine moteur de la kinésine (tête) se lie à la -tubuline en absence d'ATP (comme c'est le cas pour le couple myosine-II/actine). La liaison à l'ATP engendre le mouvement de semi-rotation. L'hydrolyse de l'ATP et la perte de Pi sépare les deux intervenants. Le mouvement de semi-rotation est plutôt aléatoire mais étant donné le nombre limité de points de fixation (uniquement fixation kinésine/\(\beta\)-tubuline) et la taille des têtes, la résultante est un déplacement dirigé. La vitesse du déplacement est estimée à 1\(\mu m/s\) pour une protéine de 10 nm. Si on rapporte cette vitesse à une échelle humaine, le déplacement des jambes (environ 1 mètre) résulterait en une vitesse de l'ordre de 360 km/h.
![]() Pour en savoir plus, consultez le document suivant : « Motor Proteins Milligan [pdf] » (426 Ko).
Pour en savoir plus, consultez le document suivant : « Motor Proteins Milligan [pdf] » (426 Ko).