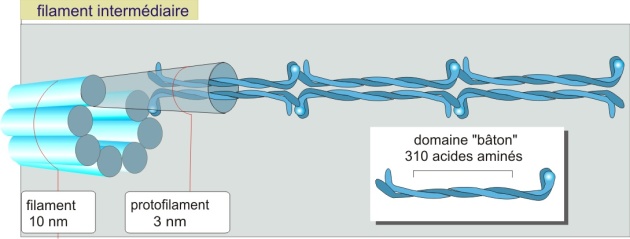
La polymérisation des filaments intermédiaires
Contrairement à l'actine et à la tubuline, qui sont des protéines globulaires, les divers types de protéines qui constituent les filaments intermédiaires sont des molécules fibreuses très allongées. Leur séquence en acides aminés favorise la formation de dimères superenroulés (figure 17 ci-dessous). Au cours de l'étape d'assemblage, deux des dimères superenroulés s'associent de manière antiparallèle pour former une sous-unité tétramérique. C'est un protofilament (3 nm de diamètre). Les tétramères s'ajoutent à un filament intermédiaire en cours d'élongation et 8 protofilaments forment le filament intermédiaire de 10 nm de diamètre. Les composants des filaments intermédiaires se trouvent rarement dans leur état libre (monomère). Ils ont toujours tendance à rejoindre un filament en polymérisation. Cependant, l'assemblage ou au contraire la dissociation du filament peut s'effectuer mais il s'agit toujours d'un processus lent (plusieurs minutes alors que pour ce qui concerne l'actine et la tubuline, seules quelques secondes sont nécessaires).
Remarque :
La phosphorylation de la protéine peut influencer le phénomène de dissociation. Par exemple la phosphorylation de la lamine (filament intermédiaire du noyau) favorise ce processus de dissociation alors que la phosphorylation des neurofilaments l'empêche.