Molécules responsables de l'adhérence à la matrice extracellulaire
Les intégrines
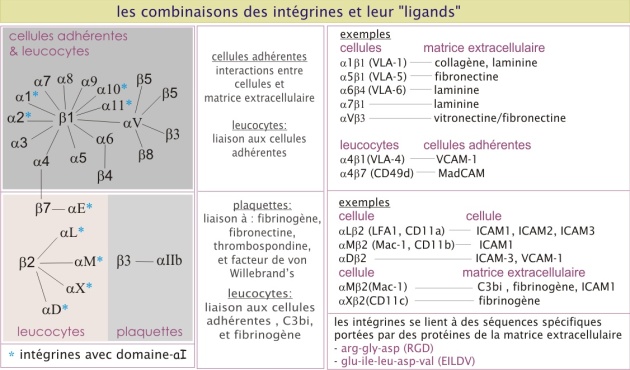
Les intégrines interagissent avec le collagène, la laminine et la fibronectine et sont les molécules d'adhérence les plus impliquées dans l'interaction avec la matrice extracellulaire. Elles sont composées de deux sous-unités transmembranaires associées de façon non covalente que l'on appelle \(\alpha\) et \(\beta\) (\(\alpha1,\ 2,\ 3...\) et (\(\beta1,\ 2,\ 3...\) et poids moléculaire d'environ 120 kDa et 90 kDa respectivement), avec plusieurs combinaisons possibles (voir la figure 21 et revoir le paragraphe « Le rôle des molécules d'adhérence dans la circulation des cellules immunitaires » dans la première section « Adhérence cellule-cellule »).
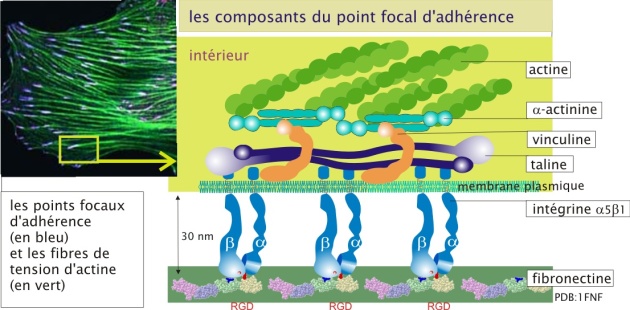
Dans les cellules constituant des tissus, comme les cellules épithéliales ou les fibroblastes, on trouve souvent l'intégrine \(\alpha5\ \beta1\), qui se lie à la fibronectine (), et l'\(\alpha6\ \beta1\) qui se lie à la laminine. La liaison des intégrines à leurs ligands est dépendante de cations bivalents extracellulaires (le Mn2+ ou le Ca2+). A l'intérieur de la cellule, les intégrines interagissent avec le cytosquelette. Leur nom dérive de leur fonction : elles forment la liaison entre la matrice extracellulaire et le cytosquelette (« intégration » entre les deux). Pour leur interaction avec la matrice extracellulaire, les intégrines sont assemblées en amas, formant ainsi un point focal d'adhérence. Du coté intracellulaire, ces amas ponctuels d'intégrines recrutent plusieurs type de protéines qui servent d'intermédiaires de liaison avec l'actine constituant le cytosquelette ; taline (230 kDa), vinculine (110 kDa) et -actinine (100 kDa).
Remarque :
Nous avons déjà évoqué un exemple de lien entre molécule d'adhérence et cytosquelette dans les jonctions d'ancrage impliquant la cadhérine. Dans ce cas particulier, c'est la \(\beta\)-caténine qui fait la liaison avec l'actine du cytosquelette. Dans le cas des intégrines, ce rôle est assumé par la vinculine. Vinculine et \(\beta\)-caténine font partie d'une même famille de protéines impliquées dans le pontage molécule d'adhérence - cytosquelette d'actine.
Les intégrines sont de véritables récepteurs. En effet leur liaison avec la matrice extracellulaire engendre des signaux cytoplasmiques importants pour la survie cellulaire et pour la réponse proliférative aux facteurs de croissance, comme le facteur épidermique de croissance (EGF) (voir ressource sur « les récepteurs »). Quand les cellules adhérentes se détachent de leur matrice extracellaire, elles meurent par un processus spécifique que l'on appelle mort programmée ou apoptose. On pense que ce phénomène est mis en place pour éviter que les cellules ne métastasent. A l'inverse, les cellules transformées (cellules tumorales) survivent au détachement, échappent à l'apoptose, et ont ainsi la capacité de métastaser (coloniser d'autres sites dans l'organisme).
En dehors des points focaux d'adhérence, il existe d'autres structures où les intégrines sont impliquées dans l'adhérence des cellules épithéliales avec leur lame basale ; les hémi-desmosomes. Dans ce cas particulier, les intégrines (\(\alpha6\ \beta4\)) sont liées aux filaments intermédiaires (kératine) du cytosquelette grâce à la plectine, molécule apparentée à la desmoplakine.
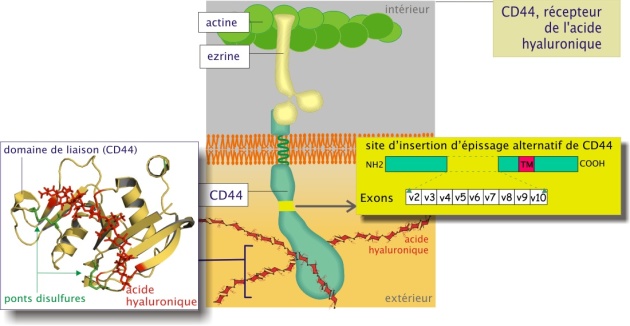
Cette famille, caractérisée au départ dans le cartilage (d'où son nom), est spécialisée dans la liaison (non-covalente !) avec les glycosaminoglycanes et reconnaissable à un motif moléculaire « domaine de liaison » (link domain) capable de se lier aux résidus glucidiques des GAG. Certaines protéines de cette famille sont impliquées dans les seules interactions matrice-matrice, comme : aggrécan, protéine de liaison du cartilage (), versican et brevican. D'autres sont impliquées dans l'adhérence cellule-matrice et cellule-cellule comme : CD44 et LYVE (lymphatic vessel endothelial hyaluronic acid receptor).
CD44 présente une variabilité moléculaire remarquable (entre 60 et 200 kDa) due d'une part à l'existence dans son gène de 10 exons (d'environ de 300 nucléotides chacun) qui subissent des épissages alternatifs divers et d'autre part, à sa liaison à des chaînes glucidiques (kératane et chondroïtine sulfate) de longueur variable. CD44 est lié au cytosquelette d'actine par l'intermédiaire d'ezrine (poids moléculaire 60 kDa).
Le CD44 joue un rôle important dans le phénomène de cicatrisation (voir aussi « les chaînes de glycosaminoglycanes (GAG) »). En effet les tissus blessés produisent énormément d'acide hyaluronique qui forme, avec la fibrine déposée par le sang, un échafaudage. Par leur CD44 membranaire, les fibroblastes se lieront avec l'acide hyaluronique, migrant ainsi dans le tissu lésé. Ces fibroblastes reconstruiront le tissu sain.
Remarque :
CD = « cluster of differentiation » = groupe de différenciation. Dénomination donnée par les chercheurs qui grâce aux molécules exprimées à la surface des cellules sanguines, les identifient précisément par reconnaissance avec des anticorps spécifiques. Exemples : les cellules sanguines sont identifiées, parmi d'autres marqueurs, par la présence de CD4 ou CD8 pour les lymphocytes-T, CD20 pour les lymphocytes-B et CD11b pour les phagocytes.