La fibronectine et la laminine
La fibronectine
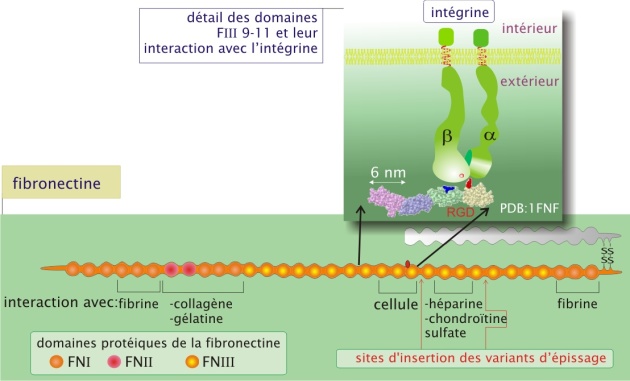
La fibronectine contribue à la fois à organiser la matrice et à favoriser l'adhérence des cellules à la matrice extracellulaire. La fibronectine, constituée de deux sous-unités \(\alpha\) et \(\beta\) (poids moléculaire d'environ 230 kDa chacune) réunies par une paire de ponts disulfure, forme un réseau fibrillaire. Grâce à l'épissage alternatif de l'ARNm, le même gène est à l'origine de plusieurs sous-unités. La protéine est essentiellement une association de trois types de domaines (I, II, III) qui se répètent plusieurs fois. Les différents domaines s'aménagent en sites d'interactions spécifiques avec d'une part les constituants moléculaires de la matrice extracellulaire (formation d'une trame) et d'autre part les cellules (par l'intermédiaire des intégrines). Un site important pour la fixation des intégrines est une séquence de trois acides aminés, arginine-glycine-acide aspartique (RGD), et se situe dans le domaine FIII10.
La protéine est libérée dans le milieu extracellulaire sous forme globulaire soluble. Le contact avec les intégrines linéarise la molécule, qui peut ainsi s'associer avec ses homologues et d'autres composants de la matrice extracellulaire. La fibronectine joue un rôle important dans le guidage des cellules lors des migrations embryonnaires chez les vertèbres (gastrulation et migration des cellules de la crête neurale). L'importance de la fibronectine est démontrée lors de la transgenèse expérimentale chez la souris : les embryons dépourvus du gène de la fibronectine ne dépassent pas le neuvième jour embryonnaire à cause d'un déficit dans le développement du mésoderme, du tube neural et des vaisseaux sanguins. Chez l'adulte, la fibronectine joue également un rôle central dans les processus de cicatrisation.
La laminine
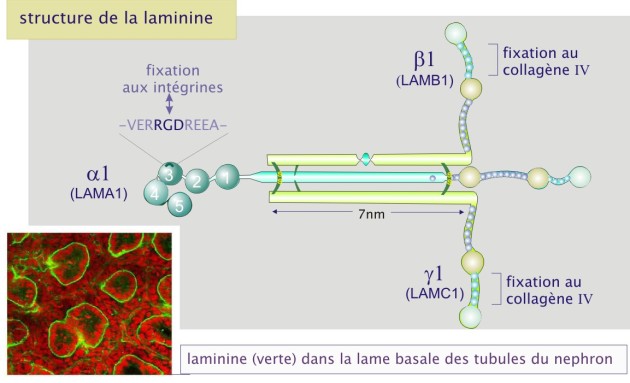
La laminine est un gros complexe protéique flexible constitué de trois chaînes polypeptidiques, \(\alpha\) (165 à 200 kDa), \(\beta\) (140 kDa) et (105 à 150 kDa). Douze formes différentes de laminine ont été caractérisées (\(\alpha\)1-5, \(\beta\)1-3 et \(\lambda\)1-3), composant ainsi onze protéines différentes (par exemple, \(\alpha1\ \beta1\ \lambda1\) ou \(\alpha2\ \beta1\ \lambda3\) etc). Les trois chaînes forment une croix asymétrique possédant plusieurs sites d'interaction avec les cellules (par l'intermédiaire des intégrines \(\alpha6\ \beta1\) et \(\alpha6\ \beta4\) ) et avec les autres composants de la matrice extracellulaire (collagène type IV et héparane sulfate). La laminine est le constituant essentiel des lames basales.
Complément : Laminine et lame basale
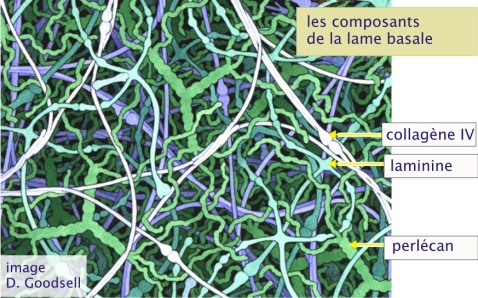
Dans certains tissus la matrice extracellulaire forme une couche fine compacte et résistante - la lame basale. On la trouve à la base de tous les feuillets épithéliaux et endothéliaux, elle entoure les cellules musculaires, les cellules adipeuses, les cellules de Schwann (qui forment la gaine de myéline entourant les axones des cellules nerveuses périphériques). D'autres part, comme dans le glomérule rénal et l'alvéole pulmonaire, la lame basale sert de filtre moléculaire. La lame basale est produite par les cellules qui s'appuient ensuite sur elle. Elle est constituée de collagène de type IV, de laminine et de protéoglycanes. Le collagène de type IV ne forme pas de fibrilles mais il forme un réseau.
Laminine et pathologie
La laminine-\(\alpha2\) est essentielle à l'intégrité musculaire. En effet une mutation dans la sous-unité \(\alpha2\), résultant en la perte d'une lame basale structurée, est responsable de la dystrophie musculaire congénitale. Cette affection est due à la mort de la cellule musculaire consécutive à l'absence d'un signal de survie qu'envoient les intégrines (en particulier l'intégrine \(\alpha7\ \beta1\)) à l'intérieur de la cellule, lorsqu'elles se lient spécifiquement avec la laminine. Dans les nerfs périphériques, on trouve aussi la laminine-\(\alpha2\) qui joue un important rôle dans la formation de la gaine de myéline périaxonale. Parce qu'elle est responsable d'une myélinisation défectueuse, l'absence de laminine-\(\alpha2\) , cause une perte de la stimulation musculaire. Dans la peau, les laminines 5 (\(\alpha3\ \beta3\ \lambda2\)) et 6 (\(\alpha3\ \beta1\ \lambda1\)) contribuent à la cohésion derme-épiderme, et des mutations de ces protéines favorisent l'apparition d'ampoules (observées chez les patients atteints d'épidermolyse jonctionnelle bulleuse).