3.1.1 L'aromaticité
On parle de composés aromatiques lorsqu'une molécule répond à certains critères. Chaque critère étant nécessaire mais pas suffisant. En effet, pour qu'un composé soit dit aromatique, il faut :
Qu'il possède 4n + 2 électrons π (pi) (n=0, 1, 2, ....). C'est la règle de Hückel ;
Que tous les électrons π soient dans un même plan.
Si ces deux conditions sont respectées alors le composé est aromatique. Si un composé ne possède que 4n électrons π alors on dit qu'il est anti-aromatique. Il existe donc trois catégories de composés :
Les aromatiques qui possèdent 4n +2 électrons π ;
Les anti-aromatiques qui ne possèdent que 4n électrons π ;
Les composés non aromatiques qui ne sont ni anti-aromatiques, ni aromatiques.
Avant de voir plus en détail la réactivité des composés aromatiques, nous allons apprendre à les reconnaître.
Il faut voir l'aromaticité comme une énergie de stabilisation. Si un composé a la possibilité, par une forme tautomère, de devenir aromatique alors c'est cette forme qui sera privilégiée car c'est celle qui donne la plus grande stabilité.
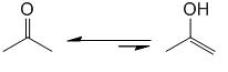
Exemple :
Une cétone existe sous deux formes, la forme cétone (la plus abondante) et la forme énol (forme minoritaire). On a alors un équilibre entre les deux formes même si cet équilibre est fortement déplacé dans le sens de la forme cétone.
Sur le second cas (voir ci-dessous), on a toujours une cétone, mais la forme majoritaire est la forme énol car dans ce cas on forme un dérivé aromatique donc il y a stabilisation par formation de l'aromaticité, la forme cétone est quasi-inexistante.