1.1.2 La stéréochimie de la double-liaison
Angles et distances :
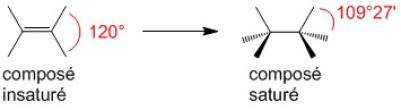
Dans un système éthylénique (double liaison), les angles de liaisons sont de 120°, en revanche pour un système saturé les angles sont d'environ 109°. C'est normal car dans l'espace qui entoure le carbone, plus il y a de substituants et plus ils sont proches les uns des autres.
Notons aussi que deux atomes de carbones liés par une double liaison sont plus proches l'un de l'autre que ceux liés par une simple liaison.
Traduit mathématiquement ça donne dC=C < dC–C.
Méthode : Déterminer la stéréochimie de la double-liaison :
Pour déterminer la stéréochimie de la double-liaison, on classe chacun des deux substituants d'un même carbone selon les règles de priorité de Cahn-Ingold-Prelog.
Si les deux substituants notés en numéro 1 sont du même côté, alors on dit que la double liaison est de stéréochimie Z (de l'allemand Zusammen ).
Si les deux substituants noté en 1 ne sont pas du même côté alors la liaison est de stéréochimie E (de l'allemand Entgegen ).

Remarque :
Les quatre substituants d'une double liaison sont dans un même plan. | 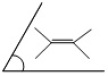 Fig.3 |





