1.2 Hydrogénation et hydrogénolyse
Il apparaît ici nécessaire de faire la différence entre hydrogénation et hydrogénolyse.
Définition :
Hydrogénation : C'est l'addition d'hydrogène sur une insaturation, ce peut être une oléfine, un alcyne, un carbonyle, un nitrile.
Hydrogénolyse : C'est la rupture d'une liaison par action d'hydrogène en présence d'un catalyseur. Le meilleur exemple est encore la déprotection du groupe benzyle et protection de la position para. En effet, la liaison O-Bn est alors hydrogénolysé par action d'hydrogène en présence de palladium.
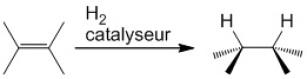
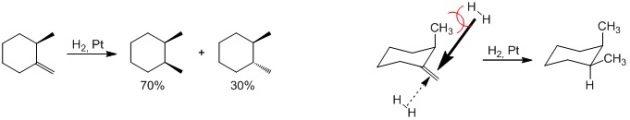
Sur les alcènes, on fait une syn-hydrogénation, c'est-à-dire que les deux hydrogènes s'additionnent du même côté de la double liaison.
Pour connaître la face d'approche de l'hydrogène, il suffit de regarder le coté le moins encombré.
L'hydrogénation se fait avec un catalyseur (Pd, Pt, Ni de Raney).