Transformation totale, mélange stœchiométrique.
Définition : Transformation totale
Une transformation est dite totale quand au moins un des réactifs a été entièrement consommé à la fin de la réaction. L'avancement final de la réaction
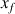 est égal à l'avancement maximal
est égal à l'avancement maximal
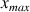

Dans l'écriture de la réaction chimique on utilisera le symbole → pour une transformation totale (au lieu de ⇌ pour un équilibre)
Définition : Réactif limitant
Dans le cas d'une transformation totale, le réactif consommé en premier est dit limitant. La transformation ne peut plus se poursuivre s'il manque un réactif. La quantité de matière du réactif limitant à la fin de la réaction est égale à 0.
Méthode : Détermination réactif limitant
Soit la réaction générale
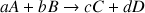
Avec
 la quantité de mole initiale de A (notée également
la quantité de mole initiale de A (notée également
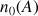 ) et
) et
 la quantité de mole initiale de B (notée également
la quantité de mole initiale de B (notée également
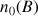 )
)
On calculera pour chaque réactif la valeur de
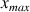 qui correspond à la consommation totale de celui-ci.
qui correspond à la consommation totale de celui-ci.
Si le réactif 1 (réactif A) est consommé :
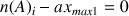 donc
donc

Si le réactif 2 (réactif B) est consommé :
 donc
donc

Des deux valeurs calculées
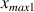 et
et
 la plus petite est égale à
la plus petite est égale à
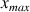 . Elle correspond à la consommation du réactif limitant.
. Elle correspond à la consommation du réactif limitant.
Si
 alors
alors
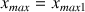 si
si
 alors
alors
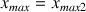
Définition : Mélange stœchiométrique
Si tous les réactifs sont consommés à la fin de la réaction, on parlera de réactifs en proportion stœchiométrique. On dit que également que le mélange des réactifs est stœchiométrique






