Exemple
On mélange
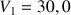 mL de
mL de
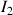 de concentration
de concentration
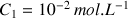 et
et
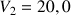 mL de thiosulfate de sodium (
mL de thiosulfate de sodium (
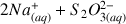 ) de concentration molaire en soluté apporté
) de concentration molaire en soluté apporté
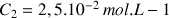 . La transformation chimique sera considérée comme totale.
. La transformation chimique sera considérée comme totale.
Calculons le nombre de mole initial des réactifs :
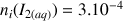 mol avec
mol avec
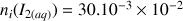
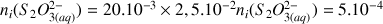 mol avec
mol avec
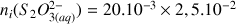
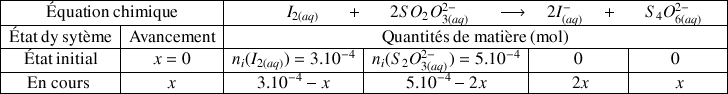
Recherchons le réactif limitant :
Si
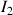 est le réactif limitant :
est le réactif limitant :
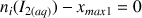 donc
donc
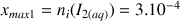 mol
mol
Si
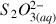 est le réactif limitant :
est le réactif limitant :
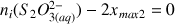 donc
donc
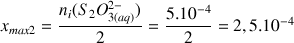 mol
mol
Comme
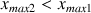 alors
alors
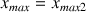
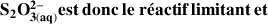
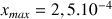 mol
mol
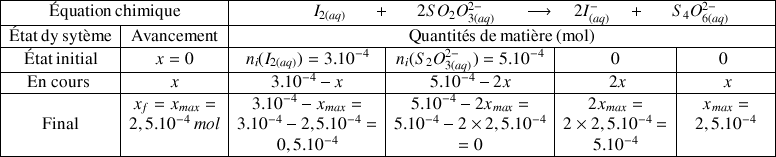
Donc à la fin de la réaction, les ions thiosulfate ont été consommés (réactif limitant), il reste
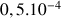 mol de
mol de
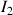 (réactif en excès) et il est apparu
(réactif en excès) et il est apparu
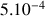 mol de
mol de
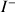 et
et
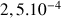 mol de
mol de
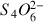 La quantité initiale de thiosulfate
La quantité initiale de thiosulfate
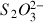 était plus importante au départ mais on voit sur le tableau d'avancement qu'il est deux fois plus consommé que
était plus importante au départ mais on voit sur le tableau d'avancement qu'il est deux fois plus consommé que
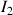 au cours de la réaction, il est finalement le réactif limitant.
au cours de la réaction, il est finalement le réactif limitant.






