Avancement, tableau d'avancement
Définition :
L'avancement d'une réaction, noté x, permet de suivre l'évolution des quantités de matière des réactifs et des produits en cours de réaction. Son unité est la mole. On utilise cette grandeur dans un tableau d'avancement (voir ci-dessous).
Définition : Établissons le tableau d'avancement pour la réaction générale aA+bB → cC+dD
Équation de la réaction | aA + bB
| |||||
|---|---|---|---|---|---|---|
État du système | Avancement | n(A) | n(B) | n(C) | n(D) | |
Initial | x = 0 | n(A)i | n(B)i | n(C)i | n(D)i | |
En cours | x | n(A)i-ax | n(B)i-bx | n(C)i+cx | n(D)i+dx | |
Final | xf | n(A)i-axf | n(B)i-bxf | n(C)i+cxf | n(D)i+dxf | |
Avec n(A)i la quantité de mole initiale de A (notée également n(A)0).
Avec n(B)i la quantité de mole initiale de B (notée également n(B)0).
Et ainsi de suite...
Dans l'état initial du système l'avancement de la réaction est x = 0.
Au cours de la réaction les quantités de matières des réactifs et des produits sont données sur la ligne qui correspond à l'état du système en cours.
Pour un réactif (ici A ou B) on soustrait à la quantité de matière initiale le produit de l'avancement par le coefficient stœchiométrique placé devant le réactif considéré dans la réaction. Ainsi la quantité de matière n(A) de A en cours de réaction est n(A) = n(A)i – a x.
Pour un produit (ici C ou D) on additionne à la quantité de matière initiale le produit de l'avancement par le coefficient stoechiométrique placé devant le réactif considéré dans la réaction. Ainsi la quantité de matière n(D) de D en cours de réaction est est n(D) = n(D)i + c x.
Complément : Avancement d'une réaction
On déduit des quantités de matière déterminées pour les réactifs et les produits en cours de réaction les relations suivantes :
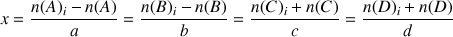
On peut donc définir l'avancement
 d'une transformation chimique à l'instant t comme étant la quantité de matière disparue (pour les réactifs) ou par la quantité de matière apparue (pour les produits), divisée par le coefficient stœchiométrique.
d'une transformation chimique à l'instant t comme étant la quantité de matière disparue (pour les réactifs) ou par la quantité de matière apparue (pour les produits), divisée par le coefficient stœchiométrique.







