Masse volumique, densité
Une masse volumique
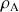 d'un corps solide, liquide ou gazeux correspond au rapport de la masse
d'un corps solide, liquide ou gazeux correspond au rapport de la masse
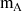 d'une quantité donnée sur le volume
d'une quantité donnée sur le volume
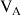 qu'il occupe avec :
qu'il occupe avec :
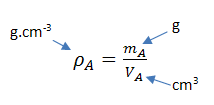
Remarque :
On utilise parfois la lettre grecque
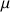 pour désigner la masse volumique :
pour désigner la masse volumique :
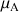 =
=
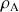
Pour les calculs de quantités de matière on utilisera la masse volumique. Cependant il arrive assez souvent que l'on préfère donner la densité plutôt que la masse volumique d'une substance chimique.
La densité
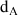 est le rapport de la masse volumique
est le rapport de la masse volumique
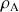 de A divisée par la masse volumique
de A divisée par la masse volumique
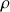 référence d'une substance de référence.
référence d'une substance de référence.

Dans le cas des liquides la référence est par défaut l'eau à 4°C. L'intérêt de cette référence est que la densité de l'eau à cette température est égale à 1 kg/L (ou 1 g/cm3). La valeur numérique de la densité
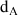 est donc la même que celle de la masse volumique
est donc la même que celle de la masse volumique
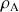 ,
,
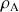 s'exprime en kg /L ou en g/cm3 (ou toute autre unité de masse sur unité de volume) et
s'exprime en kg /L ou en g/cm3 (ou toute autre unité de masse sur unité de volume) et
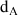 n'a pas d'unité.
n'a pas d'unité.
Complément :
Si on essaye de mélanger deux liquides non miscibles avec des densités différentes, une fois que l'agitation a cessé le liquide le moins dense se positionnera progressivement au-dessus du plus dense.
Exemple : mélange huile + eau (comme dans une vinaigrette, avec le vinaigre qui joue le rôle de l'eau).

Densité de l'eau à 20 °C : deau = 0,998
Densité de l'huile : dhuile = 0,92 (valeur moyenne pour l'huile d'olive)






