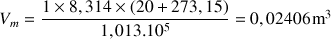Prélèvement d'un volume de gaz
On définit le volume molaire Vm qui correspond au volume d'une mole de corps pur gazeux. Celui-ci dépend de la température et de la pression dans le laboratoire mais pas de la nature du gaz. Le volume occupé par une mole de gaz est indépendant de la nature du gaz.
Dans les conditions classiques du laboratoire (T=20°C et P= 1 atm = 1,013.105 Pa) le volume molaire est Vm = 24 L.mol-1.

Explication :
Calcul du volume molaire d'un gaz Vm
La loi des gaz parfaits permet de calculer Vm :
Loi des gaz parfaits : PV = nRT avec
P : pression du gaz
V : volume occupé par le gaz
n : nombre de mole de gaz
T : température
R : constante des gaz parfaits
Dans le système international R = 8,314 J.mol-1.K-1
P en pascal, V en m3, n en mole, T en K
A T = 20°C et P = 1 atm = 1,013.105 Pa
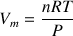
A.N. :