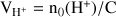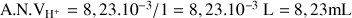Avancement maximal, réactif limitant
On verse 10,0 mL de solution d'acide chlorhydrique de concentration 1 mol.L-1 sur 100 mg de magnésium métal
La réaction chimique observée (la transformation est totale) est :
Mg (s) + 2 H+ (aq) → Mg2+ (aq) + H2(g)
Les ions Cl- sont spectateurs, ils n'interviennent pas dans la réaction.
Question
1. Établir le tableau d'avancement de la transformation, quel est le réactif limitant de la réaction ? Calculez le volume de gaz dégagé.
Quantité initiale de magnésium : n0(Mg) = m0(Mg)/MMg
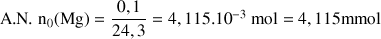
Quantité initiale de H+(aq) : n0(H+) = C.V
A.N. n0(H+) = 10.10-3 × 1 = 10 mmol
Équation chimique | Mg (s) + 2 H+ (aq) → Mg2+ (aq) + H2(g) | ||||
|---|---|---|---|---|---|
État du système | Avancement (mol) | Quantités de matière (mmol) | |||
État initial | x = 0 | n0(Mg) = 4,115 | n0(H+) = 10 | 0 | |
En cours de transformation | x | 4,115 –x | 10 – 2x | x | x |
État final = transfo. totale | xmax | 4,115 –xmax | 10 – 2xmax | xmax | xmax |
Si Mg est le réactif limitant :
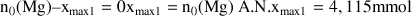
Si l'acide est le réactif limitant :
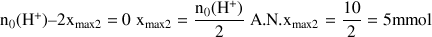
Comme
 , le magnésium est le réactif limitant.
, le magnésium est le réactif limitant.
Équation chimique | Mg (s) + 2 H+ (aq) → Mg2+ (aq) + H2(g) | ||||
|---|---|---|---|---|---|
État du système | Avancement (mol) | Quantités de matière (mmol) | |||
État final = transfo. totale | xmax=4,115 | 4,115 –xmax= 4,115-4,115 = 0 | 10 – 2xmax = 10 - 2×4,115 = 1,77 | xmax=4,115 | xmax=4,115 |
Il s'est formé 4,115 mmol de dihydrogène H2(g).Cela correspond à un volume dégagé
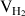 :
:
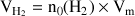
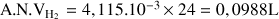
Question
2. Quelle volume d'acide chlorhydrique faudrait-il verser pour que les proportions des réactifs soient stœchiométriques.
Données : volume molaire Vm = 24 L.mol-1, masses molaires : MMg = 24,3 g.mol-1
Mélange stoechiométrique si xmax1 = xmax2 (les 2 réactifs sont limitants)
Comme
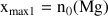 et
et
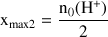 (voir question précédente) alors les 2 réactifs sont en proportion stoechiométrique si
(voir question précédente) alors les 2 réactifs sont en proportion stoechiométrique si
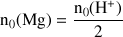
Donc la quantité d'acide à ajouter au magnésium pour que les 2 réactifs soient consommé doit vérifier
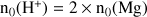
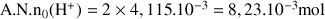
Cela correspond au volume