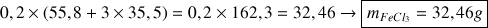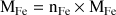Avancement maximal, réactif limitant
On fait réagir 13,95 g de fer avec un volume V= 7,2 L de dichlore (Cl2) et on obtient du chlorure de fer (III) solide. Il s'agit d'une réaction totale.
Données : volume molaire Vm = 24 L.mol-1, masses molaires : MFe = 55,8 gmol-1 et MCl = 35,5 g.mol-1
Question
1. Établir le tableau d'avancement de la réaction, déterminer le réactif limitant puis l'avancement maximal de la réaction.
Chlorure de fer(III) : FeCl3
Quantité initiale de fer : n0(Fe) = m0(Fe)/MFe A.N. n0(Fe) =
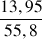 = 0,25 mol
= 0,25 mol
Quantité initiale de
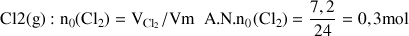
Équation chimique | 2 Fe(s) + 3Cl2(g) → 2FeCl3(s) | |||
|---|---|---|---|---|
État du système | Avancement (mol) | Quantités de matière (mol) | ||
État initial | x = 0 | n0(Fe) = 0,25 | n0(Cl2) = 0,3 | 0 |
En cours de transformation | x | n0(Fe) – 2x | n0(Cl2) – 3x | 2x |
État final = transfo. totale | xmax | n0(Fe) – 2xmax | n0(Cl2) – 3xmax | 2xmax |
Si le fer est le réactif limitant :
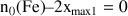
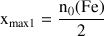
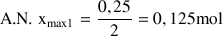
Si le dichlore est le réactif limitant :
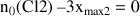
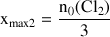
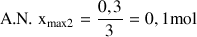
Comme
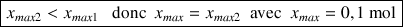 Le chlore est le réactif limitant
Le chlore est le réactif limitant
Dernière ligne du tableau d'avancement devient :
Équation chimique | 2 Fe(s) + 3Cl2(g) → 2FeCl3(s) | |||
|---|---|---|---|---|
État du système | Avancement (mol) | Quantités de matière (mol) | ||
État initial | x = 0 | n0(Fe) = 0,25 | n0(Cl2) = 0,3 | 0 |
En cours de transformation | x | n0(Fe) – 2x | n0(Cl2) – 3x | 2x |
État final = transfo. totale | xmax = 0,1 | n0(Fe) – 2xmax = 0,25 - 2×0,1 = 0,05 | n0(Cl2) – 3xmax = 0,3 - 3 x 0,1 = 0 | 2xmax = 2 × 0,1 = 0,2 |
Question
2. Quelles sont les espèces chimiques présentes à la fin de la réaction ?
A la fin de la réaction il reste 0,05 mol de Fer et il est apparu 0,2 mol de FeCl3
Question
3. Calculer la masse des solides formés et éventuellement restant à la fin de la réaction
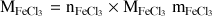 =
=