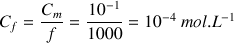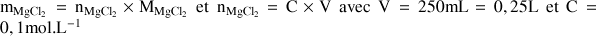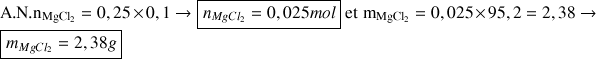Dilution
On veut préparer des solutions filles de chlorure de magnésium (Mg2+, 2Cl-) à partir d'une solution mère de chlorure de magnésium de concentration 1,0.10-1 mol/L en soluté apporté.
Question
1) On dispose d'une fiole jaugée de 250 mL pour préparer la solution mère. Quelle masse de MgCl2 doit-on dissoudre dans la fiole jaugée pour obtenir une concentration apportée en (Mg2+, 2Cl-) de 0,1 mol.L-1 ? Donnée : masse molaire de MgCl2 : MMgCl2 = 95,2 g.mol-1
Question
2) Compléter le tableau suivant qui sert à préparer les solutions filles (entraînez vous sur une feuille de papier, puis comparez avec la solution) :
Solution fille | S1 | S2 | S3 | S4 | S5 |
Concentration (mol.L-1) | 10-2 | 5.10-3 | 10-3 | ||
Facteur de dilution | 100 | 200 | |||
Volume de solution mère prélevé (mL) | 10 | 2 | 1 | ||
Volume de la fiole jaugée de la solution fille (mL) | 200 | 200 | 1000 | 1000 |
Solution fille | S1 | S2 | S3 | S4 | S5 |
Concentration (mol.L-1) = Cf | 10-2 | 5.10-3 | 10-3 | 5.10-4 | 10-4 |
Facteur de dilution = f | 10 | 20 | 100 | 200 | 1000 |
Volume de solution mère prélevé (mL) = Vm | 10 | 10 | 2 | 5 | 1 |
Volume de la fiole jaugée de la solution fille (mL) = Vf | 100 | 200 | 200 | 1000 | 1000 |
Il suffit d'appliquer les formules :
n = CfVf = CmVm avec Cf concentration de la solution fille, Vf volume de la solution fille
Cm concentration de la solution mère, Vm volume de la solution fille
Facteur de dilution
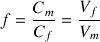
En considérant les informations données pour la solution S3 on a :
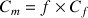 A.N.
A.N.
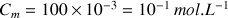
Pour S1 :
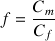 donc
donc
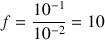 et
et
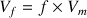 donc
donc
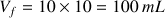
Pour S2 :
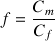 donc
donc
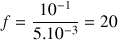 et
et
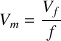 donc
donc
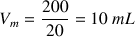
Pour S4 :
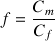 donc
donc
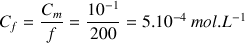 et
et
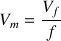 donc
donc
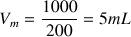
Pour S5 :
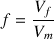 donc
donc
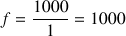 et
et