Conductivité d'une solution
On dissout 0,5 g de nitrate de calcium Ca(NO3)2 dans une fiole jaugée de 200 mL.
Données : masse molaire :
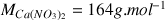
Conductivités molaires à 25°C :
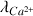 = 11,90 mS m² mol-1 ;
= 11,90 mS m² mol-1 ;
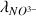 = 7,14 mS m2 mol-1
= 7,14 mS m2 mol-1
Conductivités molaires à 20°C :
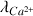 = 7,44 mS m2 mol-1 ;
= 7,44 mS m2 mol-1 ;
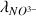 = 6,43 mS m2
= 6,43 mS m2
Question
a) Indiquer les ions présents en solution et calculer leurs concentrations.
Ca(NO3)2 → Ca2+(aq) + 2 NO3-(aq)
On va considérer que la concentration apportée en Ca(NO3)2 est c
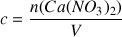 =
=
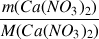 ×
×
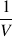 avec n(Ca(NO3)2) =
avec n(Ca(NO3)2) =
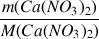
A.N. c =
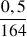 ×
×


D'après l'équation de dissolution de Ca(NO3)2 on a :
[Ca2+] = c et [NO3-] = 2c
On peut utiliser un tableau d'avancement simplifié pour établir ces relations :
Ca(NO3)2 → Ca2+(aq) + 2 NO3-(aq) | ||
|---|---|---|
n0 = c.V | 0 | 0 |
0 | c.V | 2×c.V |
Donc après dissolution
nombre de mole de Ca2+ : n(Ca2+) = c.V et [Ca2+] =
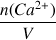 =
=
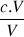 = c
= c
nombre de mole de NO3- : n(NO3-) = 2×c.V et [NO3-] =
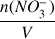 =
=
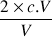 = 2c
= 2c
D'où
[Ca2+] = 0,0152 mol.L-1 et [NO3-] = 0,0305 mol.L-1
Question
b) Calculer la conductivité
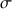 à 25 °C et 20°C. Expliquer la différence de résultat.
à 25 °C et 20°C. Expliquer la différence de résultat.
Données : masse molaire :
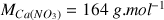
Conductivités molaires à 25°C :
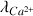 = 11,90 mS m2 mol-1 ;
= 11,90 mS m2 mol-1 ;
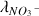 = 7,14 mS m2 mol-1
= 7,14 mS m2 mol-1
Conductivités molaires à 20°C :
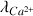 = 7,44 mS m2 mol-1 ;
= 7,44 mS m2 mol-1 ;
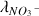 = 6,43 mS m2
= 6,43 mS m2
A 25°C
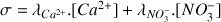
d'où
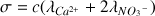
Attention il faut utiliser les concentrations en mol.m-3 et pas en mol.L-1 !
[Ca2+] = c = 15,2 mol.m-3 (donc [NO3-] = 30,5 mol.m-3
A.N.
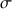 = 15,2×(11,90 + 2×7,14)
= 15,2×(11,90 + 2×7,14)
unité : mol.m-3 × mS.m2.mol-1 = mS.m-1
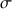 = 398 mS.m-1 à 25 °C
= 398 mS.m-1 à 25 °C
A 20°C
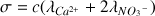
A.N.
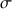 = 15,2×(7,44 + 2×6,43)
= 15,2×(7,44 + 2×6,43)
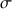 = 309 mS.m-1 à 20 °C
= 309 mS.m-1 à 20 °C
On constate que la conductivité
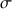 d'une solution dépend fortement de la température. Plus la température augmente, plus la mobilité des ions augmente (ce qui entraîne une augmentation de
d'une solution dépend fortement de la température. Plus la température augmente, plus la mobilité des ions augmente (ce qui entraîne une augmentation de
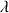 ) et donc plus la conductivité augmente.
) et donc plus la conductivité augmente.






