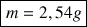Concentration molaire d'une solution
On a dissous une quantité inconnue mLiCl de chlorure de lithium dans une fiole jaugée de 200 mL.
Données : Conductivités molaires à 25°C ,
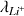 = 3,86 mS.m2.mol-1 ;
= 3,86 mS.m2.mol-1 ;
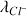 = 7,63 mS.m².mol-1
= 7,63 mS.m².mol-1
Masses molaire : MLi = 6,9 g.mol-1, MCl = 35,5 g.mol-1
Question
a) Déterminer la concentration C, en mol.L-1, de cette solution sachant qu'à 25 °C sa conductivité est
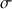 = 34,5 mS.cm-1 (on a préalablement étalonné le conductimètre).
= 34,5 mS.cm-1 (on a préalablement étalonné le conductimètre).
LiCl(s)
 Li+(aq) + Cl-(aq) donc c = [Li+] = [Cl-]
Li+(aq) + Cl-(aq) donc c = [Li+] = [Cl-]
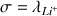 .[Li+] +
.[Li+] +
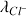 .[Cl-] d'où
.[Cl-] d'où
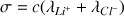 et
et
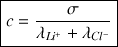
Unité de
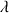 : mS.m2.mol-1 on va convertir
: mS.m2.mol-1 on va convertir
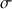 en mS.m-1 →
en mS.m-1 →
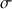 = 34,5.102 mS.m-1
= 34,5.102 mS.m-1
A.N.
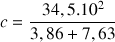 = 300 mol.m-3 →
= 300 mol.m-3 →

Question
b) Quelle masse mLiCl a été mise dans la fiole jaugée ?
n = c.V avec c = 0,300 mol.L-1 et V = 0,2 L (voir énoncé)
A.N. n = 0,3 × 0,2 = 0,06 mol
m = n.MLiCl A.N. m = 0,06 × 42,4 donc