Conductivité molaire et concentration
La conductivité
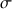 d'une solution est déterminée à partir de la mesure de sa conductance G (inverse de la résistance) et de la constante de cellule
d'une solution est déterminée à partir de la mesure de sa conductance G (inverse de la résistance) et de la constante de cellule
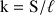
La conductivité
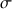 ne dépend pas de la constante de cellule donc de l'appareillage utilisé.
ne dépend pas de la constante de cellule donc de l'appareillage utilisé.
La conductivité
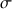 d'une solution dépend de la température, de la nature des ions en solutions et de leur concentration :
d'une solution dépend de la température, de la nature des ions en solutions et de leur concentration :
● Si la température augmente la conductivité
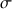 augmente.
augmente.
● La conductivité
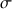 d'une solution dépend de la nature des ions en solutions.
d'une solution dépend de la nature des ions en solutions.
● La conductivité
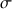 d'une solution ionique diminue après dilution. Elle dépend de la concentration en ions.
d'une solution ionique diminue après dilution. Elle dépend de la concentration en ions.
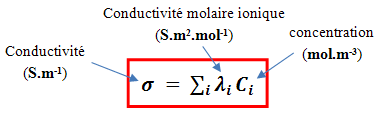
avec :
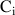 la concentration de l'espèce i,
la concentration de l'espèce i,
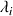 Conductivité molaire ionique de l'espèce
Conductivité molaire ionique de l'espèce
Exemple :
Conductivité d'une solution de chlorure de sodium ( Na+, Cl-) :
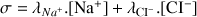
Attention :
Le respect des unités dans cette formule impose d'exprimer les concentrations molaires en mol.m-3
La quantité d'espèces présentes dans un m3 est supérieure à la quantité d'espèces présentes dans un dm3 (ou 1 L). Pour passer d'un dm3 à 1m3, il faudra donc multiplier les valeurs de concentration par un facteur 103.
Ainsi : 2 mol.L-1 correspond à 2000 mol.m-3
Conductivité molaire ionique
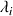
La conductivité molaire ionique de l'espèce
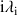 dépend de la mobilité de celle-ci dans l'eau, de la charge qu'elle porte.
dépend de la mobilité de celle-ci dans l'eau, de la charge qu'elle porte.
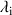 augmente quand :
augmente quand :
la mobilité de i augmente
la charge de i augmente
comme la mobilité de l'ion i augmente quand la température augmente :
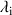 augmente quand la température augmente
augmente quand la température augmente






