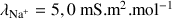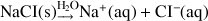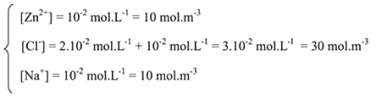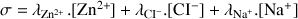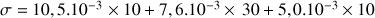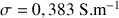Méthode : Calcul de la conductivité d'une solution
Faire le bilan ionique de la solution
Pour cela, il faut :
lister tous les cation et anions présent en solution
calculer les concentrations de chaque ion en mol.L-1
convertir chaque concentration en mol.m-3
Calculer la conductivité de la solution en additionnant le produit de la concentration avec la conductivité molaire ionique pour tous les ions.
Exemple : Exemple 1
Calculer la conductivité d'une solution contenant 10-2 mol.L-1 de ZnCl2
Données :
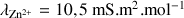 ;
;
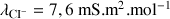
ZnCl2 est un électrolyte totalement dissocié dans l'eau.
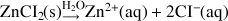
Bilan ionique 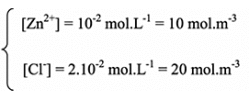
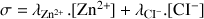
A.N. :
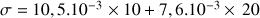
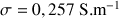
Exemple : Exemple 2
Attention :
Il faut faire attention aux unités pour la conductivité
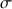 d'une solution. Dans le système international l'unité de
d'une solution. Dans le système international l'unité de
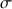 est le S.m-1 mais il arrive souvent que l'on utilise d'autres unités comme le mS.cm-1 ou le mS.mm-1.
est le S.m-1 mais il arrive souvent que l'on utilise d'autres unités comme le mS.cm-1 ou le mS.mm-1.
Si
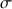 = 12,39 mS.cm-1 alors
= 12,39 mS.cm-1 alors
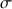 = 1,239 S.m-1
= 1,239 S.m-1
Conversion :
1 cm = 10-2 m donc (1 cm)-1 = (10-2 m)-1 et 1 cm-1 = 102 m-1 Les unités sont inversées !
1 mS = 10-3 S
Donc
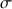 = 12,39 mS.cm-1 = 12,39 10-3 S. 102 m-1 = 12,39 10-1 S.m-1 = 1,239 S.m-1
= 12,39 mS.cm-1 = 12,39 10-3 S. 102 m-1 = 12,39 10-1 S.m-1 = 1,239 S.m-1
Si
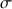 = 1,239 S.m-1 alors
= 1,239 S.m-1 alors
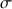 = 1,239 mS.mm-1 La valeur numérique ne change pas
= 1,239 mS.mm-1 La valeur numérique ne change pas
Conversion :
1 m = 10+3 mm donc (1 m)-1 = (10+3 mm)-1 et 1 m-1 = 10-3 mm-1 Les unités sont inversées !
1 S = 10+3 mS
Donc
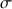 = 1,239 S.m-1 = 1,239 10+3 mS. 10-3 mm-1 = 1,239 mS.mm-1
= 1,239 S.m-1 = 1,239 10+3 mS. 10-3 mm-1 = 1,239 mS.mm-1