Étude d'une transformation par dosage (Bac S, Antilles septembre 2005)
On va étudier la cinétique de la réaction de synthèse d'un ester très odorant : l'éthanoate de menthyle. Les réactifs de cette réaction sont l'acide éthanoïque
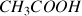 et le menthol qui est un alcool que l'on notera R-OH pour simplifier son écriture (voir formule topologique ci-dessous). La réaction est la suivante :
et le menthol qui est un alcool que l'on notera R-OH pour simplifier son écriture (voir formule topologique ci-dessous). La réaction est la suivante :
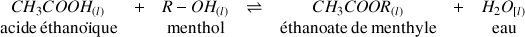
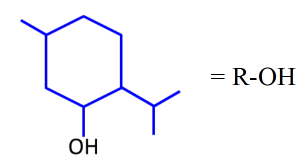
Synthèse de l'éthanoate de menthyle
Afin de synthétiser l'éthanoate de menthyle, on introduit dans un erlenmeyer maintenu dans la glace :
0,10 mol d'acide éthanoïque
0,10 mol de menthol
quelques gouttes d'acide sulfurique concentré
On répartit de façon égale le mélange dans 10 tubes à essais que l'on surmonte d'un réfrigérant à air. On plonge simultanément les 10 tubes dans un bain marie thermostaté à 70°C et on déclenche le chronomètre. À intervalles de temps réguliers, on place un tube à essai dans un bain d'eau glacée et on dose l'acide restant par une solution d'hydroxyde de sodium (
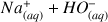 ) en présence d'un indicateur coloré approprié.
) en présence d'un indicateur coloré approprié.
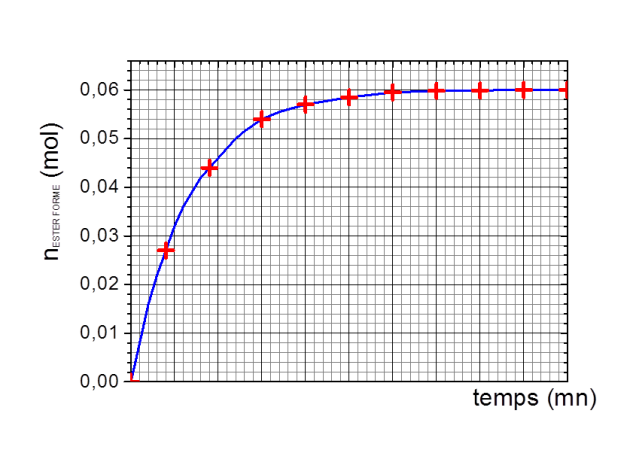
Les résultats obtenus permettent de tracer la courbe d'évolution de la quantité de matière d'ester formée en fonction du temps (
 ) donnée ci-dessous :
) donnée ci-dessous :
Question
Pourquoi faut-il placer les tubes à essais dans la glace avant titrage ? Justifier votre réponse.
La température est un facteur cinétique, son abaissement permet de ralentir la vitesse de transformation chimique. En plongeant les tubes à essai dans la glace la température du milieu réactionnel va chuter brutalement et figer le système dans l'état qu'il avait au temps t de prélèvement. On parle dans ce cas d'une trempe.
Question
Établir le tableau d'avancement suivant associé à la réaction de synthèse. Déterminer
 .
.
On considère dans ce cas que la transformation chimique est totale. Cela nous permet de calculer un
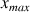 hypothéthique.
hypothéthique.
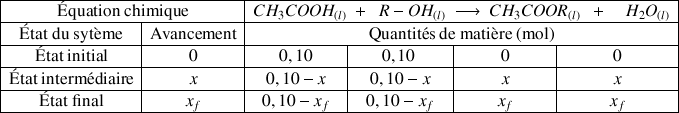
Dans ce cas hypothéthique les 2 réactifs sont limitants avec
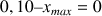 d'où
d'où
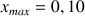 mol
mol
Question
À l'aide de la courbe précédente, calculer le rendement de la réaction. Conclure.
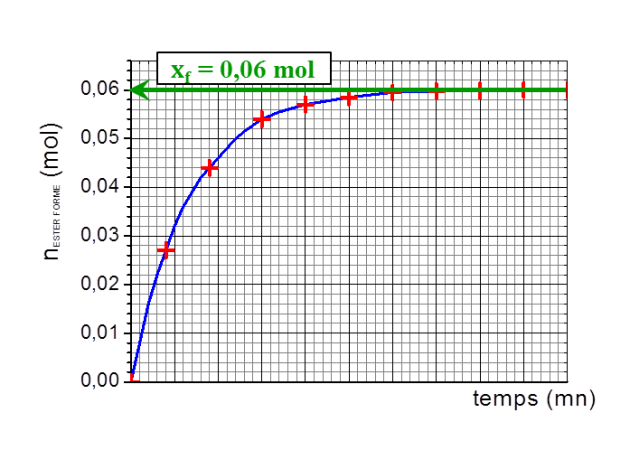
L'avancement tend vers la valeur
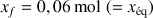 au cours du temps (voir figure).
au cours du temps (voir figure).
Le rendement de la réaction est
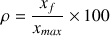
Application numérique :
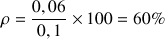
Le rendement est inférieur à 100%, donc la transformation chimique n'est pas totale. Le système atteint un état d'équilibre.
Influence des conditions expérimentales
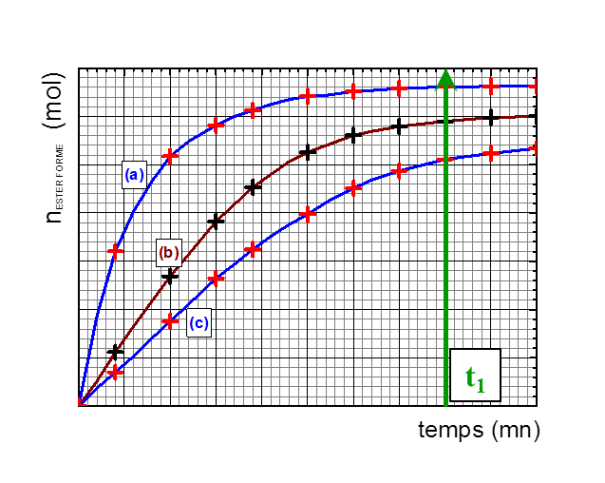
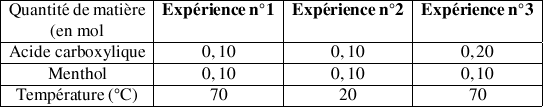
On réalise 3 autres expériences de façon analogue à l'expérience précédente mais en faisant varier les conditions expérimentales (température, quantité de matière initiale des réactifs) suivant le tableau ci-dessous :
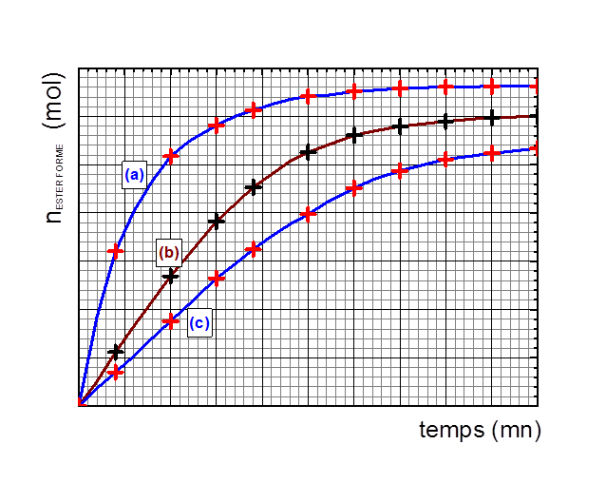
On trace à nouveau les courbes
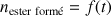 et on obtient les allures données ci-dessous.
et on obtient les allures données ci-dessous.
Question
Attribuer, en justifiant votre réponse, les courbes a, b et c aux conditions expérimentales 1, 2 et 3.
Les facteurs cinétiques concentration des réactifs ou température ont été modifiés pour les expériences n°2 et 3 par rapport à l'expérience n°1
Différence entre l'expérience n°1 et n° 2 : changement de température. L'avancement de la réaction est plus rapide pour l'expérience n°1 ( T = 70°C) que pour l'expérience n°2 ( T = 20 °C).
Différence entre l'expérience n°1 et n°3 : concentration des réactifs. L'avancement de la réaction est plus rapide pour l'expérience n°3 (
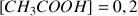 mol) que pour l'expérience n°1 (
mol) que pour l'expérience n°1 (
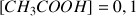 mol).
mol).
En conclusion, si on classe les expériences en fonction de la vitesse d'évolution de l'avancement x en fonction du temps on a :
Expérience 3 > expérience 1 > expérience 2
Au temps
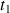 représenté sur la courbe ci-dessous on observe que
représenté sur la courbe ci-dessous on observe que
l'avancement n'évolue plus pour la courbe (a) : le système a atteint l'équilibre
l'avancement n'évolue pratiquement plus pour la courbe (b) : le système est proche de l'équilibre
l'avancement évolue encore significativement sur la courbe (c) : le système est encore loin de l'équilibre.
En reliant toutes ces informations on peut conclure que :
expérience 3 → courbe (a)
expérience 1 → courbe (b)
expérience 2 → courbe (c)