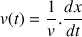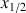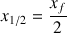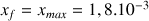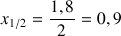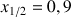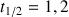Suivi cinétique par conductimétrie (tiré de Bac S, Afrique 2007)
Le 2-chloro-2-méthylpropane réagit sur l'eau pour donner naissance à un alcool. Cet alcool est le 2-méthylpropan-2-ol. La réaction est lente et totale.
On peut modéliser cette transformation par :
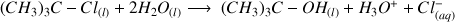
Données :
Masse molaire du 2-chloro-2-méthylpropane :
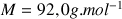 ; masse volumique :
; masse volumique :
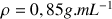 .
.
Conductivités molaires ioniques :
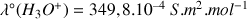 ;
;
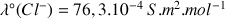
Protocole observé :
Dans une fiole jaugée, on introduit 1,0 mL de 2-chloro-2-méthylpropane et de l'acétone afin d'obtenir un volume de 25,0 mL d'une solution S.
Dans un bécher, on place 200,0 mL d'eau distillée dans laquelle est immergée la sonde d'un conductimètre. Puis à l'instant t = 0 min, on déclenche un chronomètre en versant 5,0 mL de la solution S dans le bécher.
Un agitateur magnétique permet d'homogénéiser la solution obtenue, on relève la valeur de la conductivité du mélange au cours du temps.
Question
Transformation étudiée
Montrer que la quantité initiale de 2-chloro-2-méthylpropane introduite dans le dernier mélange est
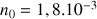 mol.
mol.
Nombre de mole de 2-chloro-2-méthylpropane introduit dans la solution S
Formules :
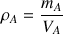 avec
avec
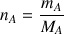 donc :
donc :
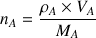
Pour être homogène on considère :
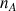 en mol
en mol
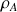 en
en
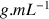
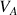 en mL
en mL
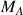 en
en
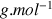
Application numérique :
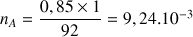 mol
mol
avec
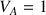 mL (on a utilisé 1 mL de 2-chloro-2-méthylpropane pour préparer la solution S)
mL (on a utilisé 1 mL de 2-chloro-2-méthylpropane pour préparer la solution S)
Ensuite on a prélevé 5 mL sur les 25 mL de la solutions S
Donc
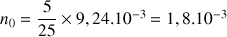 mol
mol
Question
Établir le tableau d'avancement. Quelle relation lie [
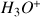 ] et [
] et [
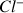 ] à chaque instant ?
] à chaque instant ?
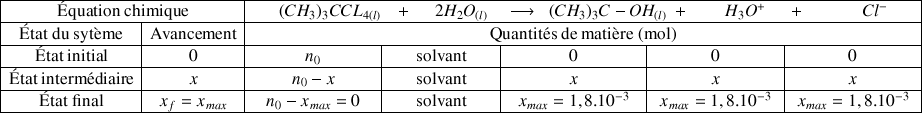
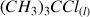 est le réactif limitant donc
est le réactif limitant donc
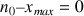 donc
donc
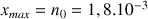 mol
mol
D'après le tableau d'avancement :
Question
Donner l'expression de la conductivité
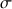 du mélange en fonction de [
du mélange en fonction de [
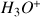 ] et des conductivités molaires ioniques.
] et des conductivités molaires ioniques.
Les espèces ioniques en solution sont :
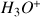 et
et
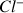
Donc
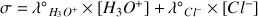
Comme
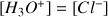
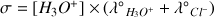
Question
Donner l'expression de la conductivité
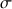 du mélange en fonction de l'avancement
du mélange en fonction de l'avancement
 de la réaction, du volume
de la réaction, du volume
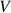 du mélange réactionnel et des conductivités molaires ioniques des ions présents dans la solution.
du mélange réactionnel et des conductivités molaires ioniques des ions présents dans la solution.
Comme
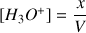
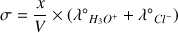
Question
Pour un temps très grand, la conductivité notée
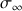 du mélange ne varie plus. Sachant que
du mélange ne varie plus. Sachant que
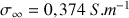 , vérifier que la transformation envisagée est bien totale.
, vérifier que la transformation envisagée est bien totale.
Pour un temps très grand l'avancement est
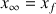
Donc
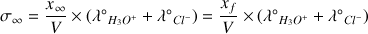
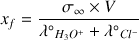
Vérifions l'homogénéité de l'équation :
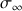 en
en
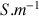 et
et
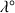 en
en
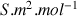 donc on doit exprimer V en
donc on doit exprimer V en
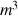
or
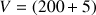 mL car on a ajouté 5 mL de la solution S dans le bécher qui contient 200 mL d'eau distillée
mL car on a ajouté 5 mL de la solution S dans le bécher qui contient 200 mL d'eau distillée
donc
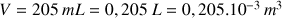
Application numérique :
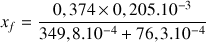
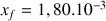 mol
mol
On observe bien que
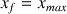 (voir calcul de
(voir calcul de
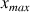 à la 2ème question), la réaction est bien totale.
à la 2ème question), la réaction est bien totale.
Question
Exprimer le rapport
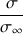 . En déduire l'expression de l'avancement
. En déduire l'expression de l'avancement
 en fonction de
en fonction de
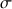 ,
,
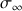 et de l'avancement maximal
et de l'avancement maximal
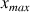 de la réaction.
de la réaction.
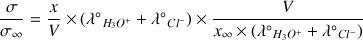
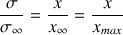 donc
donc
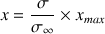
Question
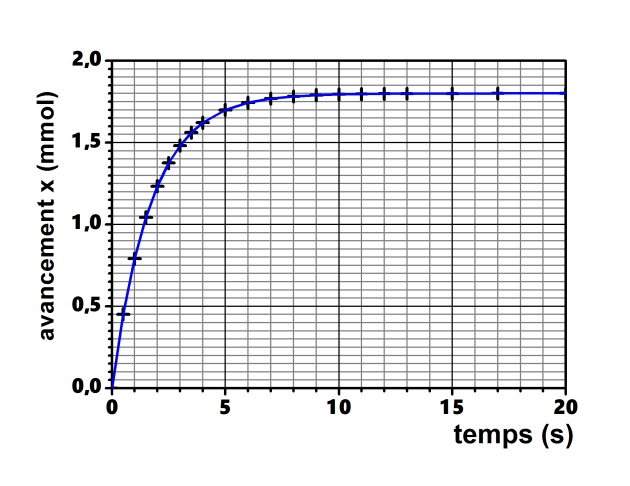
Pour
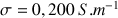 , quelle est la valeur de
, quelle est la valeur de
 ?
?
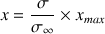 avec
avec
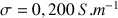
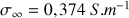
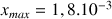 mol
mol
Application numérique :
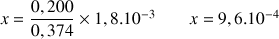 mol
mol
Question
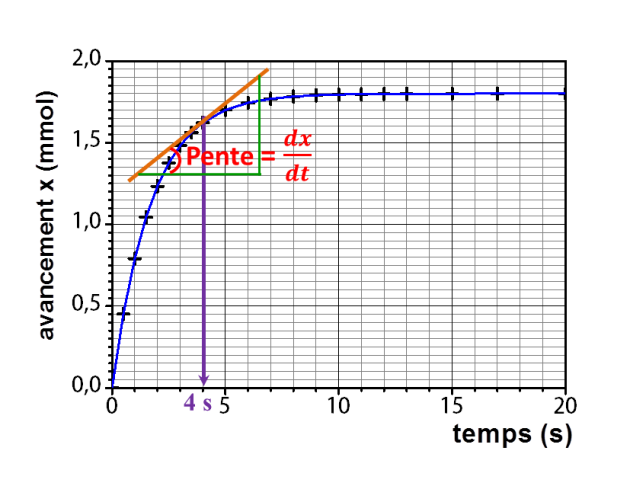
Expliquer la méthode qui permettrait d'évaluer graphiquement la vitesse volumique v de la réaction à t = 4 s.
Question
À l'aide de la courbe, indiquer comment évolue cette vitesse au cours du temps.
Question
Quel facteur cinétique permet de justifier cette évolution de la vitesse au cours du temps ?
La diminution de la vitesse au cours du temps est liée à la diminution de la concentration du réactif 2- chloro-2méthylpropane qui est consommé au fur et à mesure de l'avancement de la transformation chimique.
Question
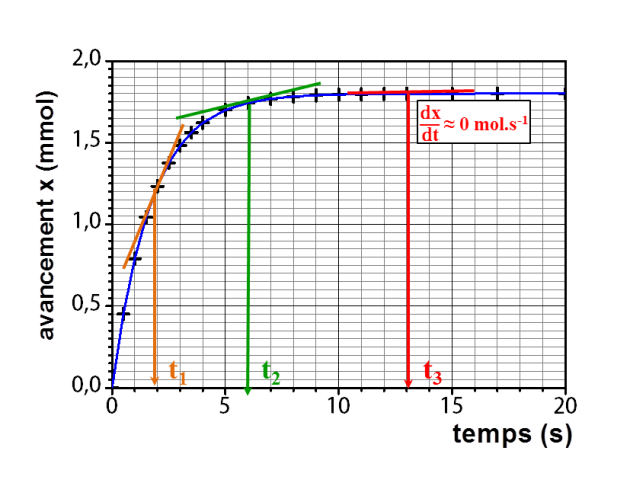
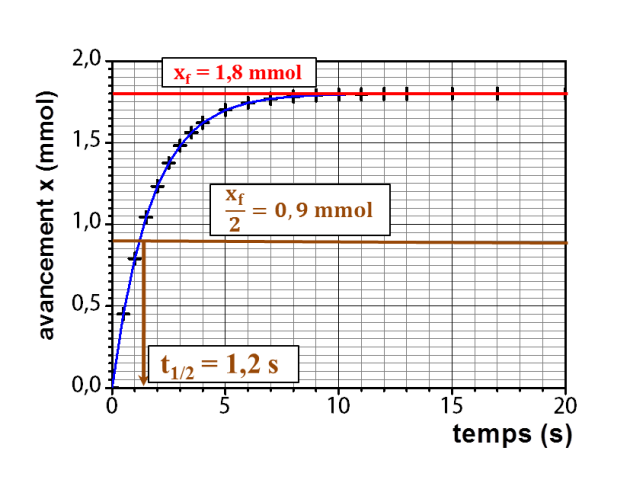
Définir le temps de demi-réaction et estimer graphiquement sa valeur.
Question
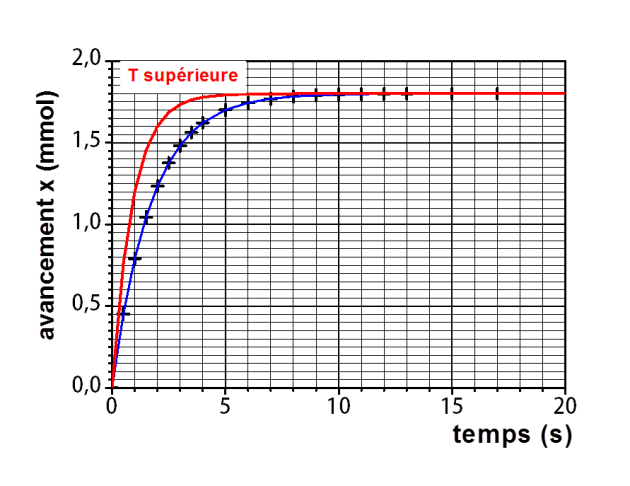
On réalise maintenant la même expérience à une température plus élevée.
Dessiner qualitativement sur le graphique l'allure de la courbe montrant les variations de l'avancement x au cours du temps.
Question
La valeur du temps de demi-réaction est-elle identique, inférieure ou supérieure à la valeur précédente ? Justifier.
Comme l'avancement final est atteint plus rapidement cela entraîne une valeur plus faible du temps de demi-réaction
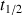 . Sur la courbe tracée en rouge on peut estimer cette nouvelle valeur à environ 0,7 s.
. Sur la courbe tracée en rouge on peut estimer cette nouvelle valeur à environ 0,7 s.