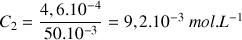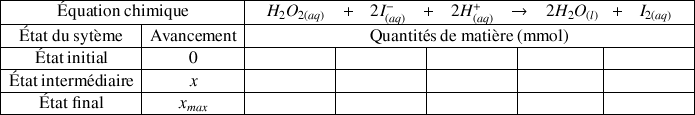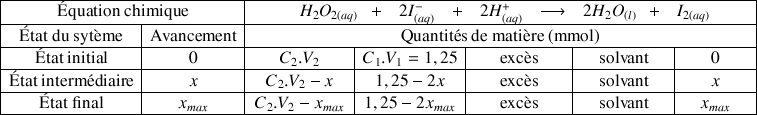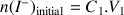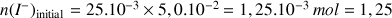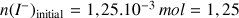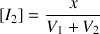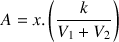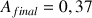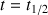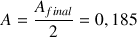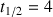Etude d'une transformation par spectrophotométrie (tiré de Bac S, Polynésie 2007)
On va étudier la cinétique de la transformation chimique décrite par la réaction suivante :
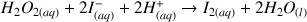
Parmi les espèces en solution, seul le diiode est coloré, il présente une couleur jaune. On peut donc le doser par spectrophotométrie.
Question
On utilise le spectrophotomètre pour réaliser la mesure de l'absorbance d'une solution aqueuse de diiode de concentration
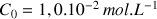 . On mesure alors une absorbance
. On mesure alors une absorbance
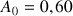 . Sachant que l'absorbance A est proportionnelle à la concentration en diiode, déterminer le coefficient de proportionnalité k.
. Sachant que l'absorbance A est proportionnelle à la concentration en diiode, déterminer le coefficient de proportionnalité k.
L'absorbance A d'une espèce en solution est directement reliée à sa concentration C dans la solution selon la loi de Beer-Lambert :
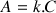 A sans unité, C en
A sans unité, C en
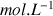 , k en
, k en
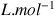
donc
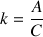
Application Numérique (A.N.) :
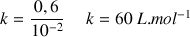
A une date
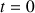 , on mélange dans un bécher une solution d'iodure de potassium (
, on mélange dans un bécher une solution d'iodure de potassium (
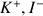 ) de volume
) de volume
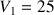 mL de concentration
mL de concentration
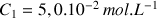 et acidifiée (les ions oxonium
et acidifiée (les ions oxonium
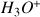 (ou
(ou
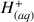 ) seront considérés en large excès) à une solution d'eau oxygénée
) seront considérés en large excès) à une solution d'eau oxygénée
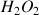 de volume
de volume
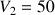 mL et de concentration inconnue
mL et de concentration inconnue
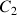 . On verse alors rapidement un faible volume (négligeable devant
. On verse alors rapidement un faible volume (négligeable devant
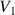 et
et
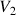 ) de ce mélange réactionnel dans une cuve qu'on introduit dans le spectrophotomètre.
) de ce mélange réactionnel dans une cuve qu'on introduit dans le spectrophotomètre.
Question
Question
Quelle relation littérale existe-t-il entre l'avancement x et la concentration en diiode dans le mélange réactionnel ?
Question
En déduire la relation littérale entre l'absorbance A et l'avancement x de la réaction étudiée.
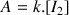 d'où
d'où
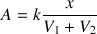
Question
En supposant que l'iodure de potassium est le réactif en défaut, quelle valeur numérique l'avancement devrait-il prendre lorsque le système chimique atteindra son état final ? En déduire la valeur finale de l'absorbance.
Si
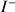 est le réactif limitant (en défaut) alors d'après le tableau d'avancement on doit avoir :
est le réactif limitant (en défaut) alors d'après le tableau d'avancement on doit avoir :
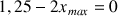 d'où
d'où
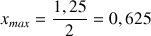 mmol
mmol
La valeur finale de l'absorbance attendue si
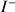 est le réactif limitant est :
est le réactif limitant est :
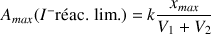
A.N. :
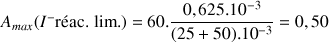
Pour être homogène on a exprimé
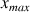 en mol et les volumes en L car
en mol et les volumes en L car
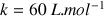
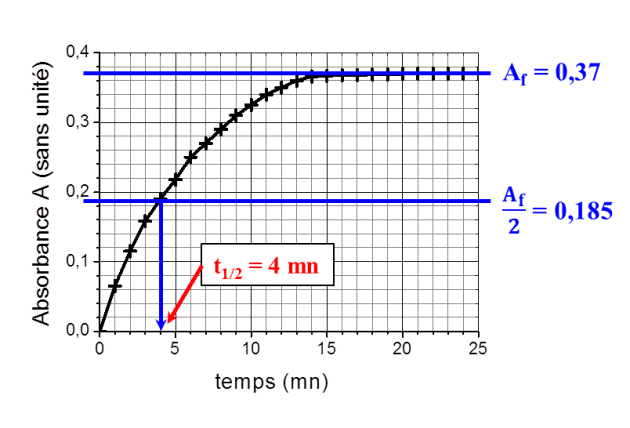
Le spectrophotomètre est relié à un ordinateur qui trace la courbe représentant l'absorbance au cours du temps, le résultat est le suivant :
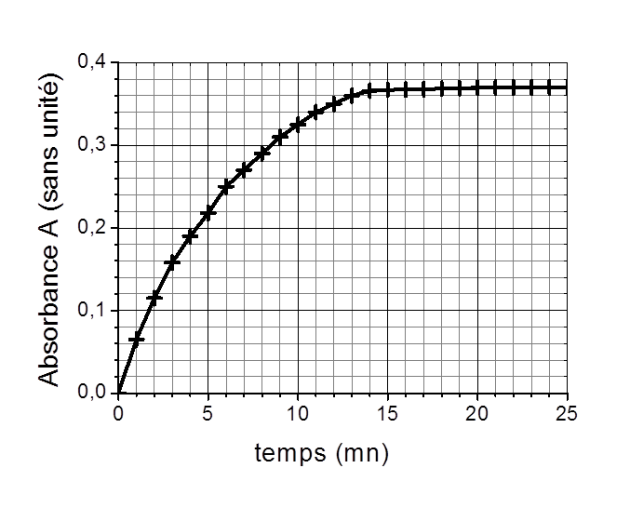
Question
Expliquer pourquoi on peut considérer qu'au bout de 15 minutes, le système a atteint son état final
- la vitesse de la réaction (
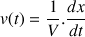 ) est quasiment nulle à t =15 mn car la pente de la tangente à la courbe (égale à
) est quasiment nulle à t =15 mn car la pente de la tangente à la courbe (égale à
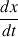 ) est quasiment nulle. Il n'y a donc plus d'évolution de la transformation chimique.
) est quasiment nulle. Il n'y a donc plus d'évolution de la transformation chimique.
Question
Déterminer après l'avoir défini le temps de demi-réaction
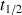 . Indiquer sur la figure donnée ci-dessus comment
. Indiquer sur la figure donnée ci-dessus comment
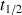 a été déterminé.
a été déterminé.
Question
La valeur finale de l'absorbance est inférieure à la valeur trouvée à la partie précédente.
A partir de la valeur prise par l'absorbance dans l'état final, montrer que l'avancement maximal est
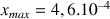 mol. L'hypothèse faite à la partie précédente est-elle correcte ?
mol. L'hypothèse faite à la partie précédente est-elle correcte ?
Dans l'état final
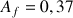 , comme la réaction est totale
, comme la réaction est totale
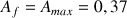
avec
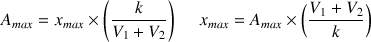
application numérique :
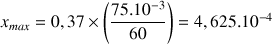 mol
mol
On retrouve une valeur inférieure à la valeur de
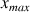 calculée en considérant que
calculée en considérant que
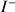 est le réactif limitant. L'hypothèse faite à la partie 2 est donc fausse, et c'est
est le réactif limitant. L'hypothèse faite à la partie 2 est donc fausse, et c'est
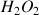 qui est le réactif limitant.
qui est le réactif limitant.
Question
Déterminer la valeur de
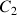 .
.
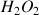 est le réactif limitant (voir question précédente) donc d'après le tableau d'avancement ;
est le réactif limitant (voir question précédente) donc d'après le tableau d'avancement ;
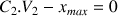 donc
donc
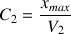
A.N.