Représentation graphique
Pour suivre l'évolution temporelle d'une transformation chimique on trace l'évolution de l'avancement de la réaction ou de la quantité de matière des réactifs (ou des produits) en fonction du temps.
Par exemple si on considère la réaction suivante :
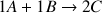
On construit le tableau d'avancement (donné ci-dessous). L'avancement de la réaction dépend du temps et est noté
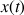 et tend vers sa valeur finale
et tend vers sa valeur finale
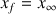 pour
pour
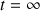 .
.
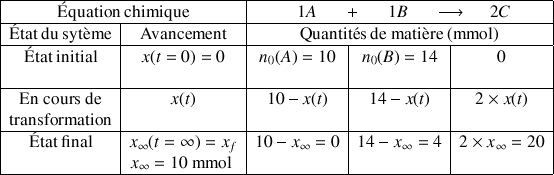
La réaction est donc totale donc
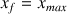 avec
avec
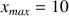 mmol car A est le réactif limitant.
mmol car A est le réactif limitant.
Donc
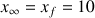 mmol
mmol
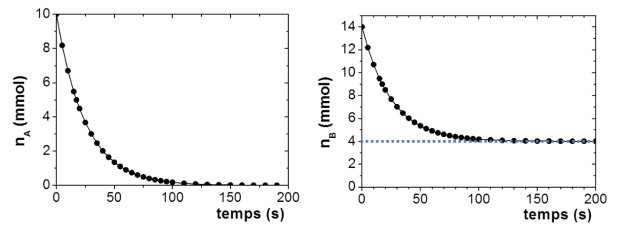
Si on trace l'évolution de la quantité de matière des réactifs en fonction du temps on observe les évolutions suivantes :
La quantité de matière des 2 réactifs diminue au cours du temps car ils sont consommés. Le système n'évolue plus au bout de 150 s car tout le réactif limitant A a été consommé. On peut considérer que
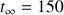 s avec
s avec
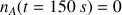 mmol.
mmol.
La réaction a atteint son état final quand les quantités de matières des réactifs ou des produits n'évoluent plus.
L'état final peut être un état d'équilibre et dans ce cas la quantité de matière n'est pas nulle pour tous les réactifs à
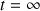 .
.
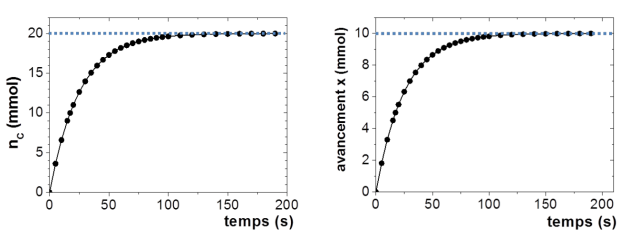
Si on trace l'évolution de la quantité de matière du produit, et de l'avancement de la réaction en fonction du temps on observe les évolutions suivantes :
On observe bien une augmentation de la quantité de produit au cours du temps et le système a atteint l'état final au bout de 150 s. le nombre de mole de produit formé ainsi que l'avancement x n'évoluent plus pour t > 150 s. Les valeurs
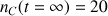 mmol et
mmol et
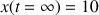 mmol correspondent à celles du tableau d'avancement.
mmol correspondent à celles du tableau d'avancement.
L'état final est atteint quand l'avancement x(t) n'évolue plus.
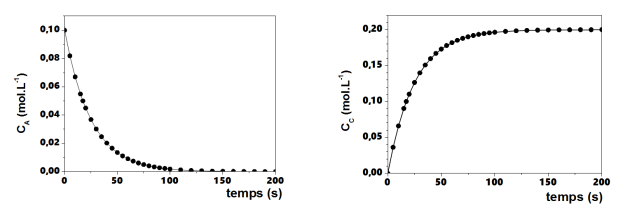
Dans le cas d'une réaction en solution on peut également tracer l'évolution des concentrations des espèces en solution.