Introduction
Définition : Cinétique chimique
La cinétique chimique est l'étude de l'évolution de l'avancement d'une réaction en fonction du temps, c'est-à-dire de la vitesse des réactions.
Fondamental :
En chimie l'étude d'une réaction chimique fait appel à des notions de thermodynamique et de cinétique.
La thermodynamique permet de prévoir si deux réactifs peuvent réagir ensemble et de déterminer l'avancement final d'une réaction.
Exemple : Acide faible dans l'eau
L'état final de la réaction d'un acide faible avec l'eau est un état d'équilibre. Cet équilibre est caractérisé par la constante d'acidité
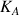 du couple acido-basique auquel appartient l'acide faible qui a réagi avec l'eau. Cette constante d'équilibre est une grandeur thermodynamique.
du couple acido-basique auquel appartient l'acide faible qui a réagi avec l'eau. Cette constante d'équilibre est une grandeur thermodynamique.
Fondamental :
La cinétique permet d'étudier la vitesse d'une réaction. Cette étude est très importante pour le chimiste car une réaction thermodynamiquement possible peut être trop lente pour être utilisée en laboratoire ou dans l'industrie. Il existe différents moyens pour augmenter la vitesse d'une réaction, ils seront présentés dans ce chapitre.
Exemple : Réactions rapide et lente
Comparons la vitesse de la réaction de deux métaux différents avec l'eau. Si on plonge dans deux béchers remplis d'eau une tige de fer et un bloc de sodium on peut constater que les réactions de dissolution (associées à des réactions d'oxydation données ci-dessous) de ces 2 métaux n'ont pas du tout la même cinétique. Le morceau de fer va s'oxyder très lentement et mettra plusieurs mois avant d'être complètement dissous. Par contre la réaction du sodium avec l'eau est très rapide et brutale. Il est possible de dissoudre ces 2 métaux dans l'eau (réaction favorable thermodynamiquement) mais avec des vitesses de réaction très différentes (cinétiques différentes).
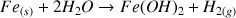 (sans présence d'oxygène)
(sans présence d'oxygène)
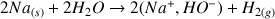
Définition : Réaction rapide
Une réaction est considérée comme rapide s'il apparaît à l'observateur que l'état final de la réaction est atteint immédiatement. Cela correspond à un temps de réaction inférieur à la seconde.
Exemple :
Réactions acido-basiques, réactions d'oxydoréduction dans une pile qui débite du courant, réactions de précipitation.
Définition : Réaction lente
Une réaction est considérée comme lente si l'état final de la réaction est atteint après plusieurs secondes voire quelques minutes.
Exemple :
De nombreuses réactions d'oxydoréduction (exemple : décomposition de l'eau oxygénée
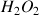 ), les réactions organiques en général (exemple : réaction d'estérification).
), les réactions organiques en général (exemple : réaction d'estérification).






