Le collagène et l'élastine
Le collagène
Environ un quart de la masse protéique d'un organisme humain, est due au collagène. Le collagène est la protéine structurale majeure qui forme des armatures, renforçant les structures telles que les tendons, la peau et les organes internes. Dans les os et les dents le collagène forme un matériau composite avec les sels minéraux (calcium et phosphate).
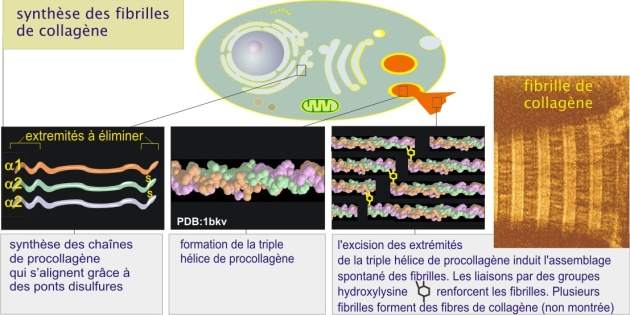
Les collagènes constituent une famille de protéines fibreuses qui forment le composant principal de la peau et de l'os. Ils se présentent sous la forme de fibres (0,5 à 3 \(\mu m\) de diamètre et30\(\mu m\) de longueur), elles-mêmes constituées de fibrilles plus ou moins nombreuses. Chaque fibrille est un ensemble des structures hélicoïdales (molécules de collagène, d'environ 50 nm de diamètre et 300 nm de longueur). Chaque structure hélicoïdale est formée de trois chaînes polypeptidiques-\(\alpha\) (poids moléculaire 100 kDa chacune) enroulées les unes autour des autres (à la manière des brins d'une corde).
A ce jour 25 gènes codant des isotypes de collagène ont été identifiés mais 15 isotypes seulement ont été retrouvés dans les tissus : types I, II, III... à XV. Chacun est une combinaison unique de trois chaînes \(\alpha\). Par exemple, le collagène I est constitué de deux chaînes \(\alpha1\) et une \(\alpha2\) alors que le collagène II est constitué de trois chaînes \(\alpha1\) identiques. Les collagènes adoptent trois configurations :
les collagènes fibrillaires, type I, II, III, V et XI ;
les collagènes en feuillet (type IV, VIII et X) (voir figure « lame basale ») ;
les collagènes de liaison, type VI, VII, IX, XII et XIV (interaction avec d'autres composants de la matrice extracellulaire).
Les cellules peuvent se lier au collagène par l'intermédiaire de la molécule d'adhérence intégrine \(\alpha2\beta1\)qui reconnaît une séquence spécifique, glycine-phénylalanine-proline-glycine-acide glutamique-arginine, située dans le domaine \(\alpha2-1\)du collagène.
Exemple :
Les fibres de collagène rendent la lame basale solidaire du tissu conjonctif sous-jacent. Le collagène est aussi présent dans la matrice du cartilage (avec l'acide hyaluronique et la chondroïtine sulfate) pour résister aux forces de tension qui s'exercent dans les articulations.
Remarque : Matrice extracellulaire et résistance des matériaux
Contrairement aux GAG, qui résistent aux forces de compression, les fibres de collagène forment des structures qui résistent aux forces de tension. Les forces de « tension et compression » sont les deux paramètres physiques essentiels à considérer lors de la construction des organismes. Les mêmes paramètres jouent un rôle dans la cohérence des matériaux de construction des bâtiments. Par exemple le béton-armé est très utilisé, car réunissant la qualité de résistance du béton à la compression et la qualité de résistance des tiges d'acier à la tension.
L'élastine
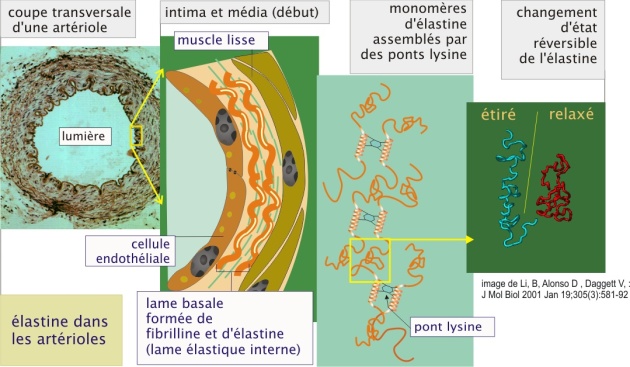
Le bon état de fonctionnement de la peau, des vaisseaux sanguins, des poumons et des tendons, est étroitement lié à leur élasticité, en plus de leur résistance à la tension. C'est un réseau de fibres élastiques présentes dans la matrice extracellulaire qui leur donne cette élasticité. Les composants principaux des fibres élastiques sont l'élastine et la fibrilline. L'élastine est une protéine très hydrophobe d'un poids de 68 kDa. Les fibres sont essentiellement composées de segments courts qui s'associent par des liaisons lysines dans le domaine hélicoïdal riche en lysine de la protéine. La raison pour laquelle ces fibres sont élastiques n'est pas encore complètement expliquée. Une hypothèse probable est que la protéine pourrait adopter plusieurs états en échangeant l'énergie par entropie : fibres étirées sous haute énergie et basse entropie, fibres relaxées sous basse énergie et haute entropie.
La production d'élastine s'arrête autour de la puberté (c'est le début du vieillissement) mais grâce à sa stabilité, l'élastine reste présente tout au long de la vie. Elle peut être dégradée par l'élastase, une enzyme relarguée par les granulocytes neutrophiles au cours de la réaction inflammatoire. A cause de l'absence de synthèse d'élastine chez l'adulte, sa perte dans les conditions pathologiques telles que sténose artérielle ou emphysème pulmonaire (par exemple induits par le tabagisme), est irréversible.