2.1 Modes de transport membranaire
Passage de la membrane par diffusion simple
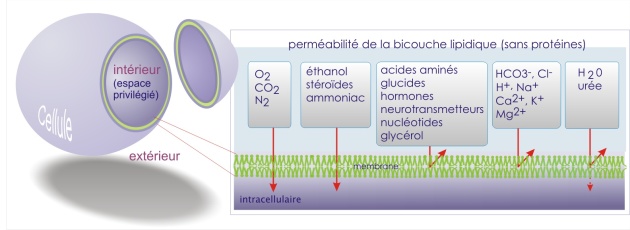
Ce mode de transport ne fait pas intervenir de protéines membranaires. Il est limité aux gaz (N2, O2, CO2, NO), aux molécules lipophiles (hormones stéroïdes et thyroïdiennes, urée, éthanol, etc.) et, dans certaines limites, à H2O.
Rappel :
Les propriétés de perméabilité d'une double couche lipidique artificielle sans protéines sont indiquées dans la figure ci-dessous.
Passage de la membrane par protéines de transport
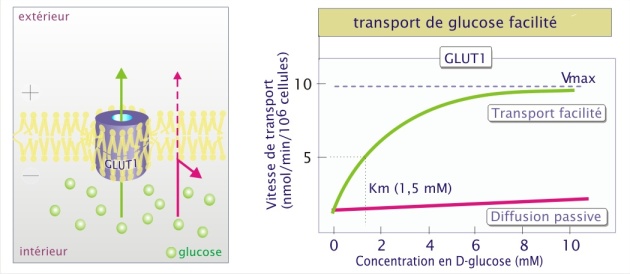
La diffusion par un transporteur augmente très largement la vitesse et la sélectivité de transport par rapport à la diffusion simple. Le transporteur de glucose (la perméase GLUT1) illustre bien ces deux aspects. Si on compare la diffusion passive à la diffusion facilitée, la différence en efficacité du transport membranaire est manifeste.
![]()
Macromedia Flash - 68Ko
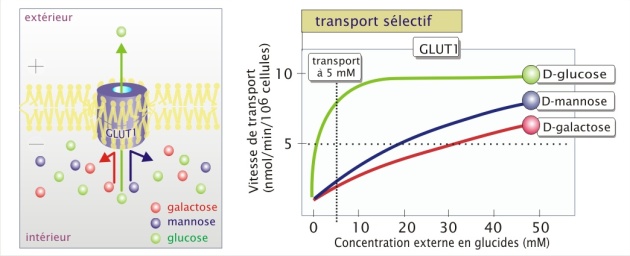
La spécificité est illustrée ici par le fait que ce transporteur qui a besoin de 1,5 mM de D-glucose pour fonctionner à 50% (Km) de sa capacité maximale (Vmax), nécessite plus de 2000 fois plus de L-glucose pour un transport équivalent de cet isomère (). De même, pour le D-mannose ou le D-galactose il lui faut respectivement 20 et 30 mM. Ainsi, lorsque ces glucides sont tous présent à une concentration d'environ 5 mM, le D-glucose passera préférentiellement.
![]()
Macromedia Flash - 99Ko
La diffusion par un transporteur permet également de transporter les solutés contre leur gradient chimique (concentration) et électrique (différence de potentiel membranaire). Le transport réalisé contre le gradient électrique ou chimique consomme de l'énergie et on parle alors de transport actif. Le transport actif permet le maintien de concentrations de solutés différentes de part et d'autre de la membrane.
Il y a trois principales classes de protéines membranaires de transport :
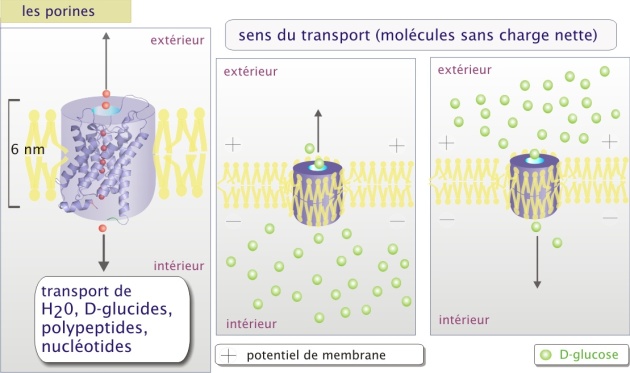
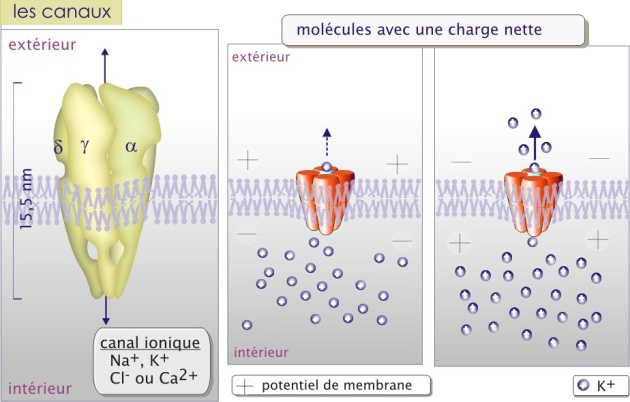
Les canaux ioniques et les porines : ce sont de véritables pores permettant le mouvement passif d'ions (canaux ioniques) ou de molécules de petite taille telles que H2O, glucides, acides aminés, nucléotides (cas des porines) avec une capacité de transport d'environ 107 à 108 molécules/sec.
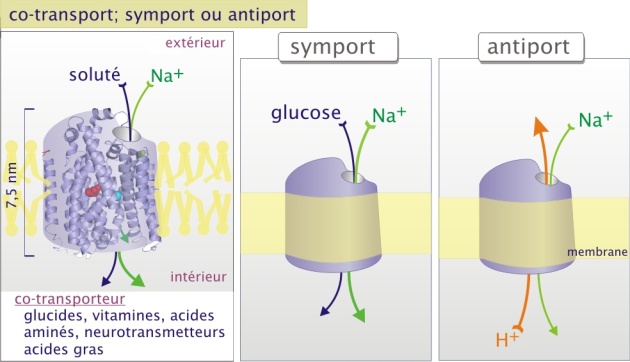
Les co-transporteurs qui assurent un transport actif (symport ou antiport) avec une capacité de transport 102 à 104 molécules/sec. Ce transport actif nécessite la constitution préalable d'un gradient ionique (par une pompe) et est aussi dénommé « transport actif secondaire ».
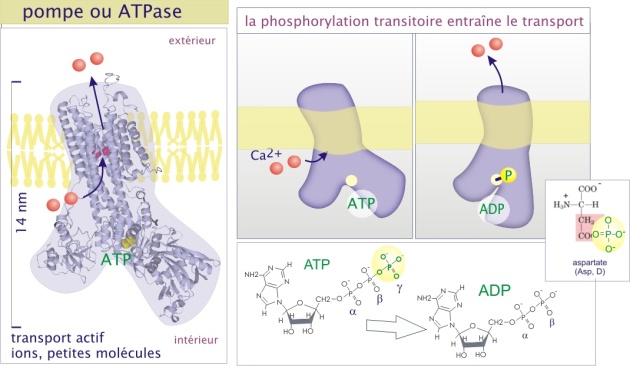
Les pompes, avec une capacité de transport actif d'environ 102 à 103 ions/sec. Ce sont des protéines qui hydrolysent l'ATP et qui sont donc qualifiées d'ATPases. Ce type de transport est dénommé « transport actif primaire ».
Transport passif : Les porines et les canaux
![]()
Macromedia Flash - 70Ko
Les canaux ioniques et les porines sont des pores constitués d'une (comme la glucose perméase GLUT et le canal de CI-), ou plusieurs sous-unités protéiques transmembranaires (comme les différents canaux de Na+, et des canaux de K+ ou encore la jonction Gap). Le passage à travers la membrane nécessite peu de changements de configuration de la protéine de transport.
![]()
Macromedia Flash - 94Ko
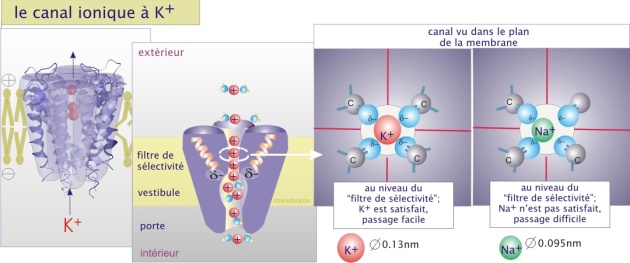
La sélectivité de transport dépend de la nature des canaux. Pour les canaux ioniques le passage semble être déterminé par deux paramètres : les forces électrostatiques à l'intérieur du canal et le diamètre du pore.
L'intérieur des canaux anioniques (comme CI-) est faiblement positif et celui des canaux cationiques (comme K+) est faiblement négatif. L'ion est alors attiré par la faible charge opposée et se positionne au milieu du canal dans un environnement électrostatique favorable. Pour la majorité de canaux ioniques, les ions qui entrent perdent la plupart des interactions électrostatiques avec l'eau et établissent de nouvelles interactions avec le pore (voire figure 4b ci-dessous). Il traversera complètement à la suite de l'entrée d'autres ions de même charge qui le repousseront vers l'autre coté du canal. Le mécanisme proposé justifie le principe du passage des ions en fonction de leur gradient de concentration. La différence de potentiel électrique au travers de la membrane (potentiel de membrane) joue aussi un rôle important parce qu'elle peut s'opposer à la sortie des ions, constituant une force de répulsion en direction opposée au passage. La résultante est nommée gradient électrochimique (voir l'animation ci-dessus).
L'ouverture des canaux ioniques est généralement sous la dépendance de la fixation d'un ligand (neurotransmetteur), de l'interaction avec un composant intracellulaire (nucléotide cyclique) ou d'un changement dans le potentiel membranaire (canaux dépendant du voltage). L'ouverture de certains canaux dépend de déplacements mécaniques provoqués par un stimulus donné (mécanorécepteurs du vestibule de l'oreille interne ou osmorécepteurs dans le cerveau).
Transport actif : Les co-transporteurs et les pompes
Les co-transporteurs et les pompes sont formés de protéines plusieurs fois transmembranaires (allant de 10 à 14 passages membranaires). Ces transporteurs n'ont pas de pore apparent. Le passage d'ions ou de petites molécules nécessite donc un profond changement de configuration. Ce transport est beaucoup plus lent mais permet aux solutés de traverser contre leur gradient électrochimique. Les co-transporteurs et les pompes transfèrent les molécules de soluté à travers la membrane selon le principe d'une réaction enzyme-substrat E+S <--> ES --> E+P; (E étant le transporteur, S le soluté dans le compartiment initial, et P le soluté transféré dans le compartiment final). Cette approche permet la détermination de constantes physicochimiques ( Vmax et Km) caractéristiques de chaque transporteur. Les transporteurs possèdent un ou plusieurs sites de fixation spécifiques du substrat. Cependant, à la différence d'une réaction enzyme-substrat, le soluté transporté n'est pas modifié.
Les co-transporteurs fonctionnent avec l'aide d'un gradient ionique constitué préalablement (souvent Na+ et parfois H+ ou CL-). Ce sont les systèmes de co-transport dans lesquels le transfert d'un soluté dépend du transfert simultané d'un second soluté. Quand les deux solutés vont dans la même direction, c'est un symport ; quand ils vont en direction opposée, c'est un antiport (figure 5).
![]()
Macromedia Flash - 29Ko
Les pompes sont définies comme des protéines de transport qui utilisent l'hydrolyse de l'ATP, suivie d'un transfert temporaire d'un phosphate (Pi) sur la protéine de transport, pour provoquer un changement de conformation nécessaire au déplacement du soluté. Bien que les détails moléculaires soient peu connus, elles transfèrent le soluté en subissant un changement de conformation réversible qui expose alternativement le site de liaison du soluté sur une face de la membrane, puis sur l'autre face. Dans le cas de la Ca2+-ATPase (pompe à Ca2+), les changements de conformation sont les conséquences de la fixation des ions transportés et un transfert de phosphate (phosphorylation) transitoire sur un résidu d'aspartate (figure 6). Ceci explique l'usage de l'ATP, qui est hydrolysé en ADP et Pi.
![]()
Macromedia Flash - 58Ko
Le prix Nobel de chimie 2003 a été décerné «pour des découvertes concernant des canaux dans les membranes cellulaires" conjointement avec Peter Agre "pour la découverte des canaux d'eau» et Roderick MacKinnon "pour des études structurelles et mécanistiques des canaux ioniques".
Dans les pages suivantes nous allons décrire les différents transporteurs regroupés selon les fonctions physiologiques dans lesquelles ils interviennent.