Théorie et exploitation
L'équation d'état d'un gaz est de la forme f(P, V , T) = 0. C'est une relation entre la pression P, la température thermodynamique T [T(K) = (°C) + 273.15] et le volume V. Ces variables d'état sont reliées dans le cas d'un gaz parfait par l'équation d'état suivante : PV = nRT (n et R désignant respectivement le nombre de moles du gaz et la constante des gaz parfaits = 8.314 J/(K.mole)).
Lorsque l'équation d'état du gaz n'est pas connue, on se propose de la déterminer expérimentalement en introduisant un certain nombre de coefficients thermoélastiques liés aux transformations du gaz. On peut définir trois coefficients thermoélastiques pour un système (P, V, T):
• Coefficient de dilatation isobare :
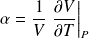 (en K-1)
(en K-1)
• Coefficient d'augmentation de pression isochore :
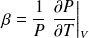 (en K-1)
(en K-1)
• Coefficient de compressibilité isotherme :
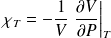 (en Pa-1)
(en Pa-1)
La donnée de deux coefficients thermoélastiques permet la détermination de l'équation d'état du gaz considéré.





