Introduction
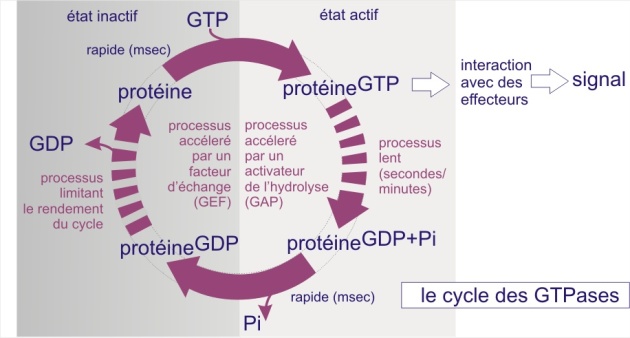
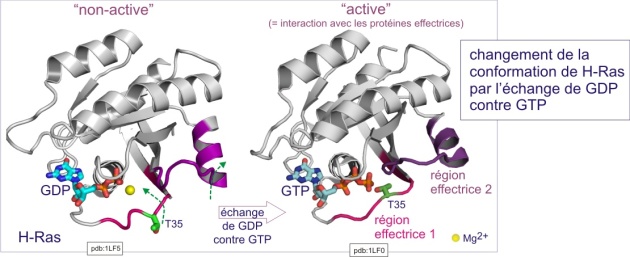
Les voies de transduction du signal emploient très fréquemment aussi des protéines liant le GTP. Comme nous l'avons plusieurs fois décrit dans les ressources précédentes, un changement de conformation survient lorsque GDP est remplacé par GTP. Dans le cas d'une voie de signalisation, c'est la fixation du ligand sur son récepteur qui déclenche cet échange de guanine nucléotides (parfois par une voie indirecte). Rappelons qu'il ne s'agit pas d'une liaison covalente, l'interaction avec les nucléotides étant due à des forces électrostatiques et des liaisons hydrogène. Toutes les protéines liant le GTP possèdent des domaines homologues, qui lient le guanine nucléotide, et qui sont responsables du cycle enzymatique suivant; 1) liaison de GTP ; 2) hydrolyse en GDP et Pi (avec une perte immédiate de Pi), suivie plus tard par 3) une perte de GDP échangé contre GTP etc. Le déroulement de ce cycle évoque celui d'une minuterie dans le hall d'un immeuble : pousser le bouton représente le chargement en GTP et l'extinction plus tardive représente son hydrolyse. Le changement de conformation induit par la liaison de GTP permet l'interaction avec les effecteurs de la cascade en aval (c'est le courant qui passe et éclaire le hall de l'immeuble) (voir figure 23A).
Jusqu'ici nous n'avons évoqué que les “petites” GTPases (GTPases monomériques), telles que eIF-2 (synthèse protéique), Rap, Sar, (transport vésiculaire REr, Golgi) ou Ran (transport nucléaire). Nous avons précisé que ces GTPases ont des activités intrinsèques lentes et nécessitent l'aide de facteurs d'échange (GEF), pour remplacer GDP par GTP, et également l'aide de facteurs qui stimulent l'activité GTPasique (les GAPs), facilitant l'hydrolyse de GTP en GDP + Pi. Nous avons également indiqué que certaines de ces GTPases sont aussi capables de se lier à des inhibiteurs tels que GDP-dissociation inhibitor (GDI), qui préviennent le remplacement de GDP par GTP. Dans cette ressource nous parlerons de trois autres types de GTPases: Ras, Rho et les GTPases hétérotrimériques.
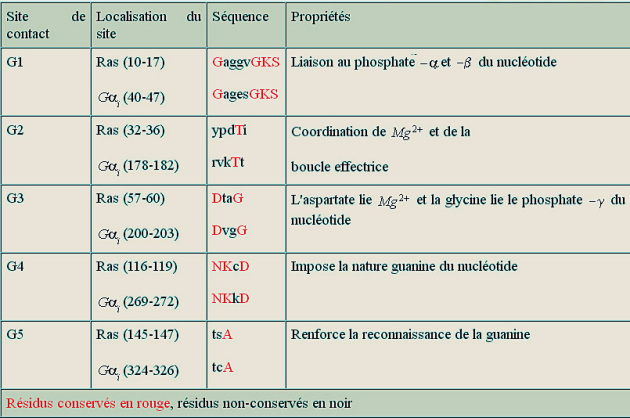
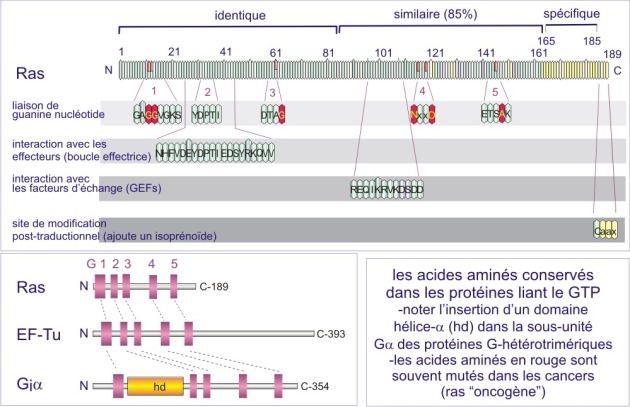
Les membres de la famille GTPase impliqués dans les voies de signalisation traitées dans cette ressource sont constitués d'une chaîne polypeptidique propre mais qui possède de courtes séquences (G1-G5) très conservées (analogues), qui, après repliement de la protéine, occupent des sites disposés de façon identique. Ces courtes séquences sont autant de sites de contact avec GTP (ou GDP) et constituent ce qu'on appelle « la poche de liaison de GTP». Le tableau 1 et la figure 24 ci-dessous montre ces courtes séquences très conservées et impliquées dans la liaison de GTP, dans la protéine H-Ras humaine (GTPase monomérique) et la sous unité ai de la protéine G bovine (GTPase trimérique). C'est un des nombreux exemples de la façon dont l'évolution a sélectionné un motif utile, celui de la liaison de GTP, mais en modifiant la séquence entourant ce motif, ce qui lui permettait de créer de nombreux variants protéiques nécessaires à différents événements cellulaires (différentes interactions).
Tableau 1
Les motifs « signature » des protéines liant le GTP
Pour plus de détails sur la topologie des domaines très conservés de RAS, .
Pour plus de détails sur la topologie des domaines très conservés de Galpha-i, .
NB La tubuline \(-\beta\), l'un des composants des microtubules, lie et hydrolyse aussi le GTP mais sa structure complètement différente, la différencie nettement des GTPases comme Sar, Rab, Ras, Ran, Rho, eIF-2 parmi d'autres.
Rafraîchir votre mémoire sur les GTPases
Les liens qui suivent, vous permettront de rafraîchir votre mémoire sur les protéines liant le GTP déjà traitées dans les ressources précédentes (le cytosquelette, la synthèse de protéines et l'acheminement des protéines vers des organelles) :
Similarités stucturales et fonctionnelles entre les GTPases et les ATPases
La myosine-II, protéine motrice qui fixe l'ATP et qui interagit avec l'actine dans la cellule musculaire, et la kinésine, qui interagit avec la tubuline, ont un domaine liant l'ATP qui ressemble au domaine qui, sur les GTPases, fixe le GTP. Le mouvement de la tête de myosine ou de kinésine occasionné par l'échange d'ADP en ATP évoque également beaucoup celui de la boucle effectrice qui caractérise les protéines liant le GTP. Cet exemple très clair illustre le façon dont les organismes utilisent des mécanismes robustes, qui on fait leur preuve au cours de l'évolution, et les adaptent pour d'autres fonctions.
![]() Pour en savoir plus sur la structure protéique responsable de la liaison des nucléotides :
Pour en savoir plus sur la structure protéique responsable de la liaison des nucléotides :
« GTPase et ATPase Fletterick [pdf] » (122 ko).