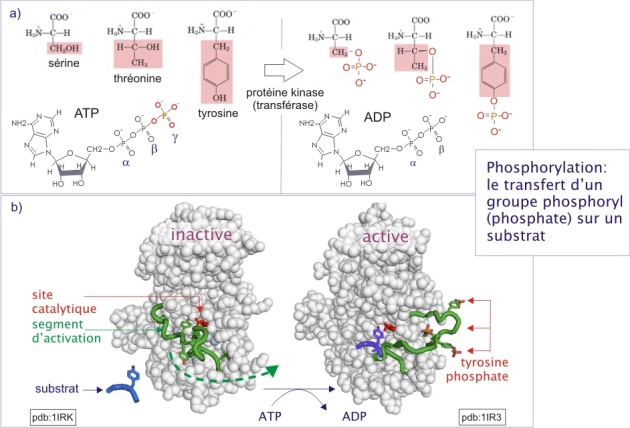
La phosphorylation et la déphosphorylation
La phosphorylation est utilisée dans de nombreux cas pour modifier l'activité de la protéine (cas des enzymes) ou pour modifier les interactions entre des composants cellulaires (cas des facteurs de transcription, des complexes de signalisation ou encore des filaments intermédiaires). L'ajout d'un ou plusieurs groupes phosphoryles (pKa 6,7 et donc di-anionique autour de pH 7,2) change dans certains cas la conformation de la protéine et la rend plus accessible (ou moins accessible) au substrat (voir figure 17). Dans d'autre cas, la phosphorylation crée un nouveau site d'interaction ou, à l'inverse, empêche certaines interactions.
Remarque :
Des analyses structurales ont montré que les résidus phosphorylés interagissent avec leur environnement de deux manières prédominantes :
des ponts hydrogènes avec un groupe amide de la chaîne principale situé à l'extrêmité amino-terminale positivement chargée d'une hélice-alpha,
des ponts salins avec un ou plusieurs résidus arginine dont le groupe guanidium chargé positivement est très impliqué dans cette liaison.
Comme nous l'avons déjà vu dans la ressource « transport membranaire », l'aspartate est phosphorylé pour faciliter le passage des ions dans les pompes Ca2+-ATPase et Na+/K+-ATPase. Dans le contexte de la signalisation cellulaire, les sérine, thréonine et tyrosine sont les acides aminés les plus phosphorylés. Les enzymes qui transfèrent le phosphate (à partir de l'ATP) sur la protéine (ou le lipide) sont appelées kinases. Les enzymes qui enlèvent le phosphate sont appelées phosphatases. Certaines de ces enzymes préfèrent transférer un phosphate sur une sérine ou une thréonine et pour celà on les appelle sérine/thréonine protéine kinases ou phosphatases. D'autres phosphorylent la tyrosine et on les appelle tyrosine protéine kinases ou phosphatases. Il existe aussi des protéine kinases et des phosphatases à « double spécificité ». Enfin, il existe des protéine kinases et phosphatases qui préfèrent les inositol lipides comme substrats et ignorent les protéines.