Chapitre 3 : Etude de systèmes naturels simplifiés
L'objectif de ce chapitre est d'étudier le fonctionnement d'un système naturel, sur la base des notions développées dans les deux chapitres précédents.
Définition : Systèmes fermés
Un système est considéré comme fermé lorsqu'il ne se produit pas d'échange entre le système lui-même et le milieu extérieur.
Dans l'environnement, une eau souterraine d'une nappe captive ou des eaux océaniques ou lacustres profondes, pour lesquelles le contact avec l'atmosphère est très limité peuvent être considérées comme des systèmes thermodynamiques fermés.
- Système carbonate
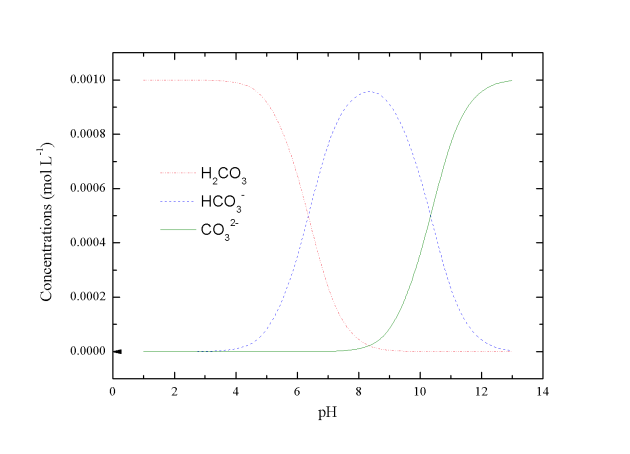
Si on considère un système carbonaté fermé tel qu'une eau profonde, les équilibres de dissolution des gaz n'interviennent pas dans la considération des équilibres. Les espèces à prendre en compte dans le cas d'un système carbonate seul sont les espèces en solution H2CO3, HCO3-, CO32-, ces espèces appartiennent aux couples acide-base suivants : H2CO3/ HCO3- (pKa1 = 6,4) et HCO3-/CO32- (pKa2 = 10,3).
Les équilibres acido-basiques qui interviennent dans un tel système sont :
H2CO3 + H2O = HCO3- + H3O+ avec ![]()
HCO3- + H2O = CO32- + H3O+ avec ![]()
Si on considère que la teneur en carbonate total est égale à 10-3 mol/L, on peut écrire :
![]()
A partir des expressions de Ka, on peut écrire :
![]() et
et ![]()
D'où :
![]()
soit :
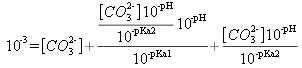
Et :
![]() donc
donc 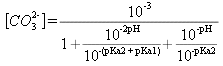
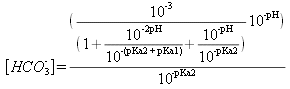 et
et 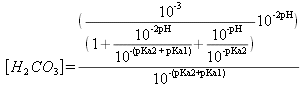
La répartition des différentes formes carbonatées en fonction du pH est donnée dans le graphique 7
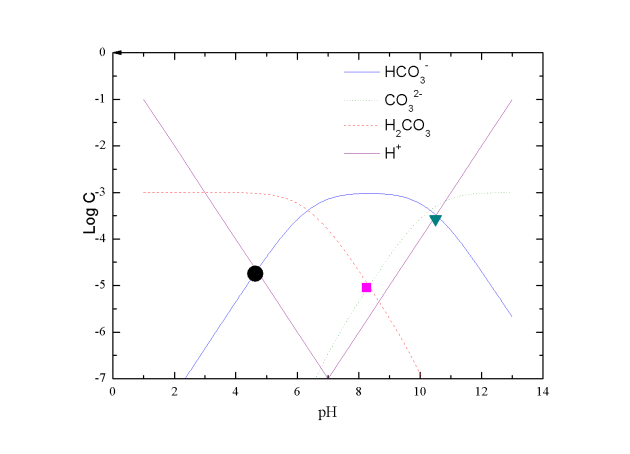
Si on représente le graphique 7 sous la forme log C = f(pH), en rajoutant les droites log [H+] = f(pH), on peut en déduire le pH d'une solution de H2CO3 (rond noir), de NaHCO3 (carré rose), ou de Na2CO3 (triangle vert) graphique 8.
-Système sulfate
Contrairement à l'exemple que nous venons de traiter dans le cas d'une eau profonde pour laquelle le contact avec un gaz n'est pas favorisé, certains milieux naturels tels que les milieux karstiques par exemple comportent des zones dans lesquelles des échanges avec des quantités finies de gaz sont possibles. Si on considère un tel système, il est nécessaire de connaître la proportion de gaz et d'eau du système. Prenons pour exemple une eau en contact avec un volume fini de SO2(g) et un rapport Veau/Vtot = 5.10-4 l/m3. Calculons en fonction du pH de milieu la répartition des différentes formes du soufre dans de telles conditions.
Calculons le volume de gaz : Vgaz = Vtot - Veau
Vgaz = Vtot – 5.10-4.Vtot soit Vgaz = 0,9995.Vtot
Le nombre de moles de SO2(g) est donc ![]() soit
soit ![]()
La dissolution de SO2(g) dans l'eau est donnée par la réaction :
SO2(g) + H2O(l) = SO2.H2O(aq), la constante de Henry de cette réaction est KH = 1,25.
SO2.H2O(aq) est un diacide dont les équilibres de dissociation sont donnés ci-dessous:
SO2.H2O(aq) + H2O(l) = H3O+ + HSO3- K1= 1,29 10-2
HSO3- + H2O(l) = H3O+ + SO32- K2 = 6,24 10-8
Le nombre de moles totales de SO2 est : nSO2 tot= nSO2(g)+ nSO2(l)
Soit: CSO2 tot Vtot= CSO2(g) Vg+ CSO2(l) Vl
La concentration en SO2 totale est alors :![]()
![]()
Sachant que ![]() , nous pouvons calculer les concentrations en H2SO3, HSO3- et SO32- grâce aux 3 équilibres précédemment écrits.
, nous pouvons calculer les concentrations en H2SO3, HSO3- et SO32- grâce aux 3 équilibres précédemment écrits.
D'après la loi de Henry appliquée à la réaction SO2(g) + H2O(l) = SO2.H2O(aq) , on peut écrire :
![]() . Sachant que
. Sachant que ![]() on obtient
on obtient ![]()
Pour l'espèce HSO3-, on a la réaction SO2.H2O(aq) + H2O(l) = H3O+ + HSO3-avec K1= 1,29 10-2
D'après cet équilibre, on peut écrire : ![]()
Pour l'espèce SO32- on a l'équilibre HSO3- + H2O(l) = H3O+ + SO32-avec K2 = 6,24 10-8
Ainsi 
En remplaçant dans l'expression de CSO2tot, on a :
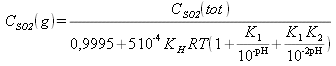
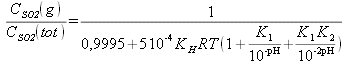
Ainsi, on peut représenter la répartition du soufre entre la phase aqueuse et la phase gazeuse en fonction du pH du milieu.