La loi de Beer-Lambert
La loi de Beer-Lambert établit une proportionnalité entre la concentration d'une entité chimique en solution, l'absorbance de celle-ci et la longueur du trajet parcouru par la lumière dans la solution. La loi de Beer-Lambert n'est cependant valable que sous certaines conditions. La lumière doit être monochromatique, la concentration des solutions doit être faible (de l'ordre de
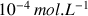 ), les solutions doivent être homogènes et le soluté ne doit pas réagir sous l'action de la lumière incidente.
), les solutions doivent être homogènes et le soluté ne doit pas réagir sous l'action de la lumière incidente.

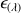 coefficient d'extinction molaire ; il varie à température fixée comme la probabilité d'absorption par la substance étudiée de la radiation
coefficient d'extinction molaire ; il varie à température fixée comme la probabilité d'absorption par la substance étudiée de la radiation
 .
.
- La largeur
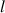 de la cuve est en cm,
de la cuve est en cm,
- La concentration
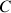 en
en
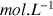
- L'absorbance
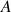 est sans unité et
est sans unité et
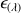 en
en
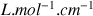 .
.
Par conséquent cette méthode peut être utilisée lorsqu'une espèce colorée se forme ou disparaît au cours de la réaction comme la réaction entre l'eau oxygénée et les ions iodure : il se forme du diiode qui est une espèce chimique colorée.






