Exemples
Exemple : Dosage d'une solution d'acide éthanoïque par une solution de soude
Dans le bécher on place un volume
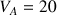 mL de la solution d'acide éthanoïque de concentration
mL de la solution d'acide éthanoïque de concentration
 à déterminer (réactif titré) et dans la burette la solution de soude de concentration
à déterminer (réactif titré) et dans la burette la solution de soude de concentration
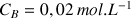 (réactif titrant). On verse progressivement un volume
(réactif titrant). On verse progressivement un volume
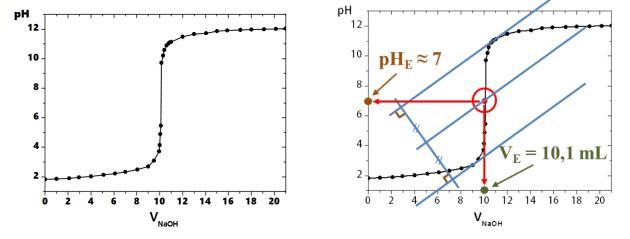
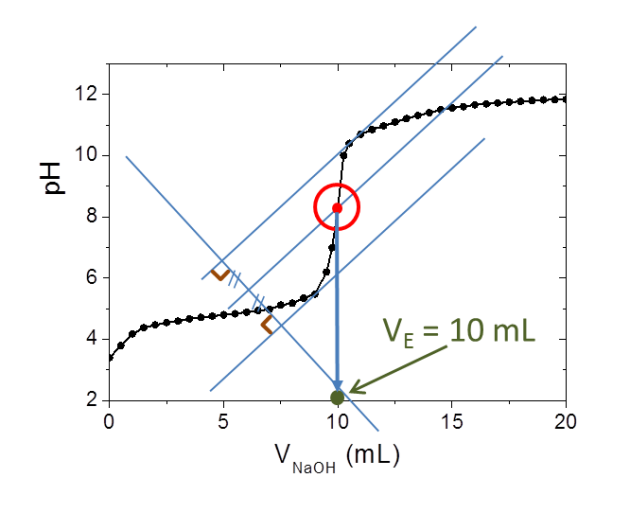
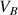 de soude dans le bécher et on mesure l'évolution du pH de la solution. On obtient le graphe ci-dessous :
de soude dans le bécher et on mesure l'évolution du pH de la solution. On obtient le graphe ci-dessous :
La réaction de titrage est :
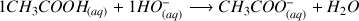
L'ion
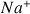 est ion spectateur qui n'intervient pas dans la réaction et qui ne modifie pas le pH. On ne le notera pas dans l'écriture de la réaction.
est ion spectateur qui n'intervient pas dans la réaction et qui ne modifie pas le pH. On ne le notera pas dans l'écriture de la réaction.
On détermine le volume d'équivalence
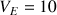 mL en utilisant
mL en utilisant
soit la méthode des tangentes (voir explication de la méthode ci-dessus et le résultat ci-dessous).
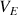 correspond à l'intersection entre la droite équidistante aux 2 tangentes et la courbe expérimentale.
correspond à l'intersection entre la droite équidistante aux 2 tangentes et la courbe expérimentale.
À partir de l'équation de la réaction et de la condition d'équivalence :
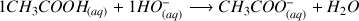

On retrouve cette relation à partir du tableau d'avancement :
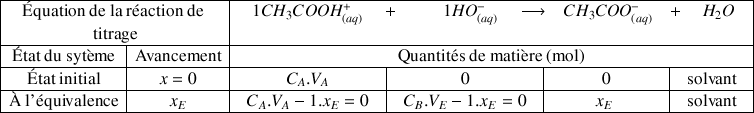
Remarque :
La réaction se déroule en milieu aqueux. On ne tient donc pas compte de la quantité de matière de l'eau.
et donc
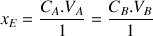 d'où
d'où

A.N.

Remarque :
On constate que sur la courbe le pH observé à l'équivalence est égal à 8,3. Le pH à l'équivalence n'est pas forcément égal à 7. Ici le pH est supérieur à 7 car à l'équivalence la solution ne contient plus d'ions
 mais uniquement de la base associée
mais uniquement de la base associée
 . On a donc une solution basique.
. On a donc une solution basique.

Exemple : Dosage d'une solution d'ammoniac par une solution d'acide chlorhydrique
Dans le bécher on place un volume
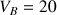 mL de la solution ammoniac de concentration
mL de la solution ammoniac de concentration
 à déterminer (réactif titré) et dans la burette la solution d'acide chlorhydrique (
à déterminer (réactif titré) et dans la burette la solution d'acide chlorhydrique (
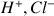 ) de concentration
) de concentration
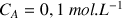 (réactif titrant). On verse progressivement un volume VA d'acide dans le bécher et on mesure l'évolution du pH de la solution. On obtient le graphe ci-dessous. Le calcul de la courbe dérivée montre l'existence d'un extrême négatif qui correspond au volume d'acide
(réactif titrant). On verse progressivement un volume VA d'acide dans le bécher et on mesure l'évolution du pH de la solution. On obtient le graphe ci-dessous. Le calcul de la courbe dérivée montre l'existence d'un extrême négatif qui correspond au volume d'acide
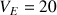 mL versé à l'équivalence.
mL versé à l'équivalence.
A partir de l'écriture de la réaction de dosage et du calcul de l'avancement de la réaction à l'équivalence on obtient :
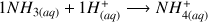
et donc
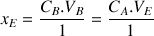 d'où
d'où

A.N.

Remarque :
On constate que sur la courbe le pH observé à l'équivalence est égal à 5,1. Le pH est inférieur à 7 (donc la solution est acide) car à l'équivalence la solution ne contient plus d'ammoniac mais uniquement de l'acide conjugué
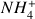 .
.
Exemple : Dosage d'une solution solution d'acide chlorhydrique par une solution de soude
Dans le bécher on place un volume
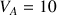 mL de la solution d'acide chlorhydrique de concentration
mL de la solution d'acide chlorhydrique de concentration
 à déterminer (réactif titré) et dans la burette la solution de soude de concentration
à déterminer (réactif titré) et dans la burette la solution de soude de concentration
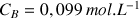 (réactif titrant). On verse progressivement un volume
(réactif titrant). On verse progressivement un volume
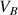 de soude dans le bécher et on mesure l'évolution du pH de la solution. On obtient le graphe ci-dessous :
de soude dans le bécher et on mesure l'évolution du pH de la solution. On obtient le graphe ci-dessous :
A partir de l'équation de la réaction et de la condition d'équivalence

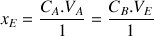 d'où
d'où

A.N.
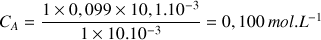
Remarque :
On constate que sur la courbe le pH observé à l'équivalence est égale à 7. À l'équivalence il n'y a plus d'ions
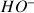 provenant de la solution de soude, ils ont tous été neutralisés par les ions
provenant de la solution de soude, ils ont tous été neutralisés par les ions
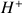 versés. Il n'y a plus que de l'eau dans la solution (en négligeant les ions
versés. Il n'y a plus que de l'eau dans la solution (en négligeant les ions
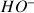 et
et
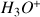 qui proviennent de l'autoprotolyse de l'eau qui sont en très faible quantité). Le pH est donc égal à 7.
qui proviennent de l'autoprotolyse de l'eau qui sont en très faible quantité). Le pH est donc égal à 7.